Utvikling og godkjenning av koronavaksiner
Publisert
Hovedelementer i utvikling og godkjenning av koronavaksiner
SARS-CoV-2 er ikke det første nye koronaviruset som har gitt sykdom hos mennesker i moderne tid. I perioden fra 2002-2004 var det et større utbrudd av Severe Acute Respiratory Syndrome (SARS-CoV-1) i Asia, og i perioden fra 2012 har det vært flere utbrudd og tilfeller av Middle East Respiratory Syndrome (MERS-CoV). Arbeidet med å utvikle vaksiner mot koronavirus hadde derfor pågått i mange år før det nåværende utbruddet med SARS-CoV-2. Det gjorde det mulig å iverksette arbeid med flere vaksinekandidater for SARS-CoV-2 alt tidlig i pandemien (1-3). Noen av disse er allerede blitt godkjent og er i bruk som vaksiner mot Covid-19, mens andre vaksinekandidater er under utvikling (4).
Målet i vaksineutvikling er å fremskaffe et produkt hvor nytten av vaksinasjon og beskyttelsen mot sykdommen det vaksineres mot er større enn risikoen for bivirkninger. Siden vaksiner er forebyggende legemidler og vanligvis gis til store grupper med friske personer, er toleransen for bivirkninger lavere enn for terapeutiske legemidler som gis til syke pasienter. Før en vaksine kan godkjennes må det derfor gjennomføres prekliniske og kliniske studier etter strenge retningslinjer. Etter at en vaksine er godkjent fortsetter kvalitetsarbeidet med studier av effekt og sikkerhet i faktisk bruk.
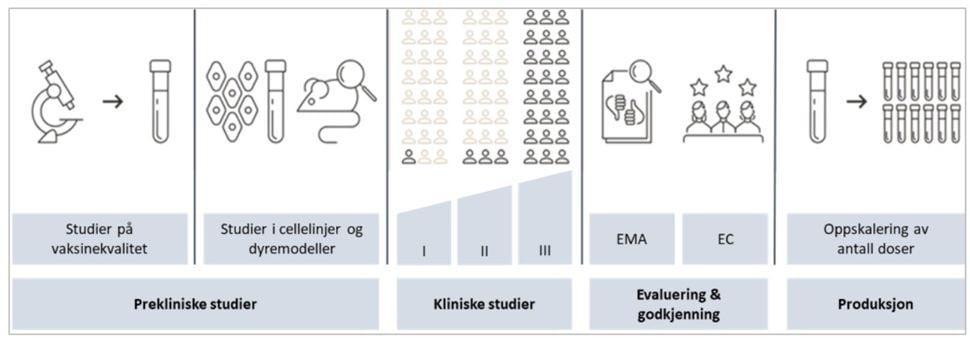
Vanligvis utføres de ulike fasene i vaksineutvikling - fra laboratorieundersøkelser til storskala testing i mennesker under pågående utbrudd – sekvensielt og i henhold til rekkefølgen i figur 1. Det er viktig å merke seg at når utviklingen har gått raskere enn vanlig for covid-19 vaksinekandidatene, så skyldes ikke det at man har hoppet over noen trinn i prosessen. Det er flere grunner til at utviklingen kunne gå så raskt. For det første var allerede mye av grunnforskningen på antigen (hvilke deler av viruset som stimulerer til dannelse av antistoffer og reagerer med dem) og vaksineplattformer gjort. For det andre ble det på grunn av pandemiens omfang og alvorlighet lagt svært store ressurser ned i arbeidet fra mange hold. I tillegg ble det spart tid ved at studiene i de ulike kliniske fasene av vaksineutviklingen pågikk parallelt (6). Også når det gjelder godkjenningen av koronavaksinene, så har vaksinene blitt vurdert etter de samme dokumentasjonskrav som vaksiner som godkjennes under normale forhold. Når selve godkjenningsprosessen likevel har gått raskere, skyldes dette at EMA har lagt til rette for en raskere saksbehandling (5).
Mer om utvikling og godkjenning av nye vaksiner
Prekliniske studier
Prekliniske studier foregår i laboratoriet, først ved såkalte in vitro-studier (studier som foregår «i glasset»; altså undersøkelser i reagensglass og petriskåler som ikke involverer levende organismer), og deretter ved in vivo-studier («i det levende»; studier som foregår i hele, levende organismer, som celler, planter, dyr) (7). I de prekliniske studiene av farmasøytisk kvalitet undersøkes de enkelte vaksinekomponentene (se vaksinasjonshåndboka, Innholdsstoffer i vaksiner), vaksinens endelige formulering og produksjonsprosessen i detalj for å ivareta sikkerheten og finne den beste løsningen for hver enkelt vaksine (8). Deretter testes vaksinens virkningsmekanismer (se vaksinasjonshåndboka, Prinsipp for vaksinasjon), sikkerhet og effekt i dyremodeller (8;9). Vaksiner som viser god sikkerhet og god immunrespons hos dyr kan gå videre til kliniske studier.
Kliniske studier
Ved kliniske studier testes vaksinen i mennesker. Man kan få gode data fra ulike prekliniske studier, men vaksiners effekt og sikkerhet må like fullt undersøkes i mennesker før de kan godkjennes og tas i bruk (10;11). Tilsvarende vil testing i andre arter gjerne også gi gode data, men dyremodeller kan ikke alltid forutsi hvordan vaksinen påvirker mennesker.
Kliniske studier av nye vaksinekandidater kjøres i flere faser med ulike hovedformål og et økende antall deltagere:
- Fase 1: Vaksinen testes i noen ganske få (inntil 100) personer, ofte unge og friske frivillige. Hensikten er å undersøke om vaksinen er sikker for mennesker, samt om og hva slags immunrespons den gir (vaksinens sikkerhet og immunogenisitet).
- Fase 2: I tillegg til å undersøke sikkerhet og immunogenisitet søker man også å finne rett dosering. Det er i fase 2 også vanlig å teste vaksinen i frivillige som tilhører gruppene vaksinen er ment for (aldersgrupper, helsetilstand). Fase 2 omfatter langt flere personer enn fase 1, gjerne flere hundre. Studiene bør være designet som randomiserte kontrollerte studier (randomised controlled trials, RCT) der studiedeltakerne fordeles tilfeldig til ulik dosestørrelse og doseintervall, og der man også inkluderer en gruppe som får en annen vaksine eller placebo. Studiene bør være dobbelt-blindete, som innebærer at hverken deltakerne eller forskerne vet hvem som har fått hva, slik at det ikke skal påvirke fortolkning av resultatene. Hensikten med studiedesignet er å undersøke om variasjoner i utfallet (bivirkninger, immunrespons, beskyttelse) skyldes tilfeldigheter eller om de kan tilskrives den nye vaksinen - evt spesifikke doseringer og vaksinasjonsregimer for denne.
- Fase 3: Nå testes vaksinen ut på flere tusen frivillige ved dobbelt-blindete, randomiserte studier. Kontrollgruppen får enten placebo eller en annen godkjent vaksine. Med større omfang er hensikten å teste vaksinens egenskaper i ulike befolkningsgrupper for å avdekke om det er systematiske forskjeller i beskyttende effekt eller sikkerhet etter for eksempel aldersgruppe eller helsetilstand. Resultatet av disse studiene er viktige for å avdekke om personer i enkelte alders- eller sykdomsgrupper bør/ikke bør få vaksinen av hensyn til variasjoner i sikkerhet eller effekt. I fase 3 måles effekten først og fremst ved antall sykdomstilfeller blant vaksinerte sammenlignet med uvaksinerte. I tillegg undersøker man gjerne om vaksinen ser ut til å redusere risiko for alvorlige utfall (som sykehusinnleggelse, intensivinnleggelse eller død) blant vaksinerte, samt vaksinens effekt på smittespredning og eventuell flokkimmunitet.
- Fase 4: Studier hvis siktemål er å teste vaksinens effekt under de forhold den reelt brukes i. Dette er studier som kjøres på vaksiner som allerede har markedsføringstillatelse, og de ser på effekt og sikkerhet av vaksinen «i virkeligheten». Flere ulike studiedesign kan brukes til dette formålet. Ett eksempel på en vaksine der det kjøres jevnlige studier av denne typen er influensavaksinene.
Vaksiner godkjennes normalt på bakgrunn av data fra fase 1-3. Ettersom studienes begrensete omfang sjelden gir konklusive funn på alle relevante spørsmål studeres imidlertid vaksiners sikkerhet - og i noen grad også effekt - også etter godkjenning (se egen omtale nedenfor).
Godkjenning av vaksiner
Godkjenningsprosessen for vaksiner til bruk i EU/EØS-området foregår i det europeiske legemiddelsamarbeidet, der Det europeiske legemiddelkontoret (European Medicines Agency, EMA) er koordinerende enhet (5). Legemiddelverket, som nasjonal myndighet, er en del av dette nettverket gjennom deltagelse i de ulike vitenskapelige komiteene. Det er komiteen for humane legemidler (CHMP) i EMA som utreder søknader om markedsføringstillatelse (MT) og gir en anbefaling til EU-kommisjonen, som formelt vedtar MT. MT vil da gjelde i alle medlemsland, inkludert Norge. For å få en MT må det foreligge et positivt nytte-risikoforhold. Legemiddelverket har en aktiv rolle i det europeiske legemiddelsamarbeidet for å vurdere effekt og sikkerhet av vaksiner, og kontrollerer at vaksinene produseres etter gjeldende kvalitetskrav (8).
Vanligvis leveres alle data i en søknad om MT inn samtidig. Avhengig av dokumentasjonspakkens innhold og omfang, samt konteksten (smittesituasjon o.a.), kan søknaden føre til godkjenning i form av en full eller en betinget MT. En betinget MT må fornyes årlig frem til produsenten kan levere fullstendige data. Når datagrunnlaget fyller betingelsene for en full tillatelse, kan en betinget MT omgjøres til en full MT.
En betinget MT krever mindre robuste data enn en full MT, og kan utstedes i situasjoner der en sykdom utgjør en alvorlig trussel mot folkehelsen og det ikke finnes andre behandlingsmuligheter. For en betinget MT må følgende kriterier oppfylles:
- vaksinenes umiddelbare tilgjengelighet er mer nyttig for folkehelsen enn risikoen ved å vente på mer fullstendige data
- tilgang på vaksinen oppfyller et udekket medisinsk behov
- produsenten kan levere fullstendige data i etterkant
Behandlingstiden for en søknad om MT (betinget eller full) er vanligvis 210 dager, men det kan i praksis ta opptil ett år fordi søker må besvare spørsmål underveis. For legemidler (inkludert vaksiner) mot covid-19 har EMA kortet ned behandlingstiden til rundt 150 dager. I en krisesituasjon som nå, tilbyr EMA i tillegg en løpende vurdering (“rolling review”) av data for vaksinekandidater med lovende resultater fra prekliniske og innledende kliniske studier. Under en “rolling review” leveres dataene på kvalitet, effekt og sikkerhet inn fortløpende. Når dokumentasjonspakken vurderes å være komplett, vil produsenten formelt søke om MT. En slik søknad vil bli behandlet raskt, og denne ordningen kan derfor forkorte behandlingstiden ytterligere. Prosessen vil imidlertid ta lenger tid om man må avvente mer robuste data, tilleggsanalyser eller inspeksjoner. Den samlete dokumentasjonen på søknadstidspunktet avgjør om vaksinen får en full eller en betinget MT. Det foreligger for øvrig et eget planverk for overvåking av sikkerhet og effekt for covid-19-vaksiner i Europa (12).
Oppfølging av vaksiner etter godkjenning
Kvalitetsarbeidet for vaksiner fortsetter også etter at en vaksine er godkjent.
- Vaksineprodusentene utfører kvalitetstester på hvert eneste produksjonsparti for å sikre at de tilfredsstiller myndighetenes krav. I tillegg testes hvert vaksineparti av et uavhengig myndighetslaboratorium før de tas i bruk. Legemiddelverket deltar i den sammenheng i et samarbeid med kontrollaboratorier i andre europeiske land, og får slik viktig informasjon om den farmasøytiske kvaliteten av covid-19 vaksinepartier som skal brukes i Norge.
- Vaksinesikkerheten overvåkes ved omfattende nasjonale, regionale og globale nettverk som fortløpende overvåker meldte bivirkninger for hver vaksine, i den hensikt å se etter signaler av betydning for vaksinesikkerheten.
- Enkelte vaksiner følges også nøye for eventuelle endringer i beskyttende effekt over tid eller som følge av mutasjoner/endringer av mikroben, samt vurderinger av behov for oppfriskningsdoser generelt eller i noen grupper. Her er influensavaksine det beste eksemplet, fordi influensavirusenes raske utvikling krever årlig evaluering og eventuelt oppdatering av vaksinevirusene for å sikre at de gir beskyttelse mot sirkulerende virus. En tilsvarende problemstilling kan vise seg å være av betydning også for vaksiner mot SARS-CoV-2.
I Norge er det Legemiddelverket (SLV) som har ansvar for å overvåke sikkerhet ved bruk av vaksiner etter godkjenning. SLV har veletablerte systemer for å oppdage og følge opp mistenkte bivirkninger etter vaksinasjon. Meldinger fra helsepersonell om mistenkte bivirkninger mottas og behandles av Folkehelseinstituttet (FHI) og de regionale legemiddelinformasjonssentrene (RELIS) på vegne av SLV. Meldinger fra privatpersoner håndteres av Legemiddelverket. Les mer om bivirkninger etter vaksinasjon og myndighetenes håndtering av bivirkningsmeldinger i vaksinasjonshåndboka.
Det er viktig at mistanker om nye, uventede eller alvorlige bivirkninger fanges opp tidlig, slik at man kan utrede om det foreligger en årsakssammenheng mellom bivirkningen og vaksinering. Dette gjelder også bivirkninger og følger som oppstår etter lengre tid eller er svært sjeldne. Bivirkningsovervåking er videre viktig for å avdekke om noen pasientgrupper har høyere risiko for bivirkninger enn andre. Veldig sjeldne tilstander vil ikke kunne oppdages før et stort antall individer er vaksinert. Derfor er avanserte legemiddelepidemiologiske analyser og det samarbeid SLV har med legemiddelverk i andre europeiske land (via EMA) viktig. I sum gjør bivirkningsovervåkingen at SLV og FHI kan informere befolkning og helsepersonell om viktige bivirkninger og gi råd om videre vaksinasjon.

