08. Diagnostikk av tuberkulose
Oppdatert
Kapittelet tar for seg symptomer og diagnostikk av tuberkulose.
8.1 Lungetuberkulose
8.1.1 Symptomer ved lungetuberkulose
Lungetuberkulose er symptomfattig i tidlige faser av sykdommen. Da insidensen av tuberkulose var høy i Norge, ble 15–20 % av tuberkulosepasientene oppdaget ved rutinemessig skjermbildefotografering eller lungerøntgen, og mange av disse følte seg friske. Likevel anga mange ”symptomfrie” pasienter større velbefinnende og vektøkning etter noen ukers tuberkulosebehandling.
Følgende symptomer regnes som klassiske for lungetuberkulose
- Langvarig hoste (over tre uker), etter hvert med oppspytt
- Vekttap
- Nedsatt allmenntilstand
- Feber
- Nattsvette
Sjeldnere symptomer er
- Brystsmerte
- Tungpust
- Blodtilblandet oppspytt
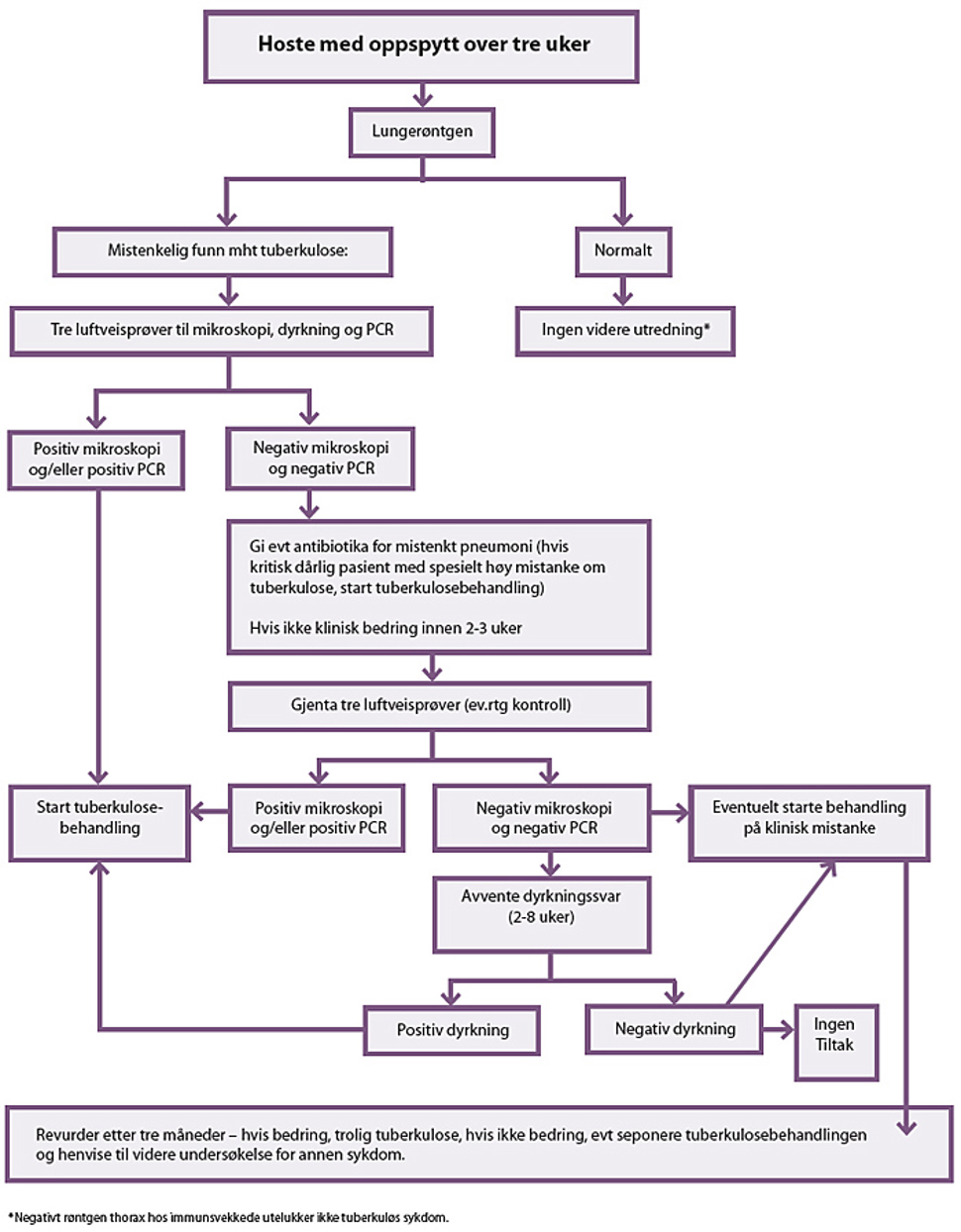
Figur 8.1 Utredning ved mistenkt lungetuberkulose
Hoste og oppspytt er hovedsymptomene ved lungetuberkulose. Disse symptomene er imidlertid lite spesifikke og ses ved mange andre tilstander. Oppspyttet kan være mukoid, purulent eller blandet med blod. Pasienter med hoste og ekspektorat av mer enn 3 ukers varighet bør henvises til røntgenundersøkelse av lungene.
Hemoptyse er i dag et sjeldent symptom ved lungetuberkulose, men forekommer ved alle destruktive prosesser som bryter ned blodårer. I dag er hemoptyse vanligere ved maligne lidelser, bronkiektasier og langvarige lungeinfeksjoner forårsaket av M. avium-intracellulare-komplekset (MAC).
Trøtthet, slapphet, manglende appetitt, vekttap, feber og nattesvette er sene allmennsymptomer som varsler om langtkommet sykdom. Disse symptomene er imidlertid i dag vanligere ved andre sykdommer som for eksempel kreft og andre infeksjoner.
8.1.2 Vurdering av funn ved lungerøntgen
Røntgenforandringer er den viktigste indikasjonen på, men er ikke diagnostisk for, lungetuberkulose. En mistanke om tuberkulose etter funn på lungerøntgen, styrkes hvis personen har symptomer på tuberkulose, har vært eksponert for tuberkulose eller har oppholdt seg i lengre tid i et område med høy forekomst av tuberkulose, og har positiv IGRA eller Mantoux.
Alle lungerøntgenfunn som vurderes som mulig tuberkuloserelaterte, skal utredes videre med bakteriologisk prøve fra luftveiene. Positiv direkte mikroskopi eller genteknologisk påvisning av M. tuberculosis skal alltid verifiseres med dyrkning.
Følgende røntgenfunn gir mistanke om tuberkuløs sykdom: kaverner, ”bløte” uskarpe og utbredte infiltrater og infiltrater som progredierer ved kontroll av røntgenbildet.
Hos barn med primær lungetuberkulose har 7–30 % røntgenforandringer som hilusglandelforstørrelse eller parenkyminfiltrasjon (pneumoni). Parenkyminfiltrasjonen består av et primærfokus i en lunge med tilhørende forstørrelse av lymfeknuter i lungehilus som begge kan forkalke med tiden. Forstørrede lymfeknuter i hilus kan gi kompresjon av bronkier med segmental – eller lobær – atelektase.
Hos voksne oppstår hyppigst post-primær-tuberkulose. De røntgenologiske lungefunnene varierer fra bløte og uskarpe infiltrater, pneumoni, til veldefinerte rundskygger og kaverne(r). Forandringene er ofte lokalisert i de apikale, bakre segmentene i overlappene fulgt av apikale segment av underlappene og fremre segment av overlappene (Barns et.al, 1988; Poppius og Thomander, 1957; Farman og Speir, 1986).
Pneumoniske, uskarpe infiltrater er ofte flere og mer sammenflytende ved tuberkulose enn ved ordinære pneumonier, men de kan ikke adskilles røntgenologisk. Kaverner dannes når det sentrale nekrotiske materialet finner vei ut gjennom en ”større” bronkiegren - drenasjebronkus. Kaverneveggen kan være irregulær og ofte flere millimeter tykk. Væskespeil er vanlige, men ikke alltid til stede, og avhenger av hvor drenasjebronkus er lokalisert. Små rundskygger kan vedbli etter avsluttet behandling. Disse skyldes fibrose. Personer fra Asia og Afrika har ikke sjelden bestående forstørrede hiluslymfeknuter, noe som er uvanlig hos europeere.
Fibrose og forkalkning er vanlig ved tuberkulose som forblir ubehandlet over tid. Dette fører til skrumpning med opptrekning av lungehili, eller overtrekninger av deler av mediastinum hvis prosessen er ensidig. Svær pleurafortykkelse med forkalkning er et vanlig resultat av pneumothoraxbehandling og pleuritt.
Immunologisk betinget avgrensning av sykdomsprosessen er viktig for klinikk og røntgenfunn. Ved dårlig immunitet (som hos hivpasienter og andre immunsvekkede pasienter) er diffus sykdomsutbredelse vanlig og kaverner sjeldne. Negativt lungerøntgen utelukker ikke sykdom hos immunsvekkede, og disse pasientene må utredes adekvat.
Fibrøse (også kalt «spesifikke») forandringer er suspekte på gjennomgått tuberkulose. Inntil 5% av pasienter med aktiv tuberkulose har fibrokalsinøse forandringer i overlappen forenlig med forandringer etter tilhelet primær tuberkulose.
Risikoen for reaktivering av tuberkulose hos tuberkulinpositive personer med fibrotiske lesjoner er tyve ganger høyere enn hos personer med normale røntgenfunn (Horsburgh, 2004). Hvis aktiv tuberkulose er utelukket, er disse pasientene kandidater for forebyggende behandling, se kapittel 10.7.8.
8.1.3 Standardisering av svar på lungerøntgen ved screening for tuberkulose
De som undersøkes ved rutinemessig undersøkelse og screening er i utgangspunktet presumtivt friske mennesker. Hensikten med undersøkelsen er rask diagnose for å sikre rask behandling av den enkelte og dermed også forhindre smitte til andre.
Det er viktig at man utfører undersøkelsene på en slik måte at man fanger opp syke personer i tilstrekkelig grad, men ikke ender opp med å utrede for stor andel med funn uten klinisk relevans. Det vil altså være et skille mellom radiologisk diagnostikk i screeningøyemed og diagnostisk øyemed. Dersom man avdekker alvorlige tilstander som ikke er tuberkuloserelatert, må dette selvsagt undersøkes videre.
I hovedsak bør funnene deles inn på følgende måte:
- Ingen aktuell patologi
- Mulig tuberkuloserelaterte funn
- Mistanke om aktiv tuberkulose
- Andre patologiske funn som må følges opp
Ved presis og standardisert svar på røntgenundersøkelsen vil mottaker av svaret kunne iverksette tiltak ut fra dette:
- Ingen oppfølging nødvendig
- Etterundersøkelse vanlig prioritet (vanligvis i løpet av noen dager)
- Etterundersøkelse øyeblikkelig hjelp
Ved mistanke om aktiv tuberkulose eller mulig tuberkuloserelaterte funn på lungerøntgen skal det alltid gjøres:
-
Mikrobiologisk diagnostikk (dyrkning, mikroskopi, evt. PCR)
I tillegg eventuelt:
- IGRA
- Supplerende radiologiske undersøkelser
Funnene må alltid vurderes individuelt, men man bør tilstrebe å ende opp med en klar konklusjon og anbefaling av tiltak. Tabell 8.1 er et forslag til slik standardisert angivelse av funn og påfølgende tiltak hos mottaker av røntgensvaret. Se kapittel 7.2.2 for angivelse av smitteverntiltak i påvente av etterundersøkelse.
| Vurdering av rtg.thorax som ledd i screening for tuberkulose | ||||
| Funn som kan være tuberkuloserelaterte | Andre funn | |||
|
|
|
|
|
| Svarkategori | Mistanke om aktiv tuberkulose | Mulig tuberkuloserelaterte funn | Ingen aktuell patologi | Andre funn (Beskrives) |
| Tiltak | Etterundersøkelse øyeblikkelig hjelp | Etterundersøkelse vanlig prioritet | Avsluttes | Etterundersøkelse (hastegrad avhengig av tilstand) |
8.1.4 Laboratorieundersøkelser
Lungetuberkulose mistenkes på grunnlag av røntgenfunn, men bekreftes ved hjelp av mikrobiologisk diagnostikk. Dette innebærer direkte mikroskopi av luftveismaterialet (farget med Ziehl-Neelsens metode eller auramin-rhodamin), genteknologisk undersøkelse og bakteriologisk dyrkning av luftveisprøve. Adekvate prøver må alltid innsendes til dyrkning.
IGRA (interferon gamma release assay) brukes som hovedregel kun til å avklare om pasienten har latent tuberkulose, ikke til diagnose av tuberkulosesykdom.
Tuberkulinprøving, IGRA og ventrikkelaspirasjon er spesielt nyttig ved utredning hos barn (se avsnitt 8.3 og forøvrig 6. Økt risiko for smitte og sykdom).
Hematologiske og biokjemiske prøver
Antallet hvite blodlegemer er vanligvis ikke forhøyet ved tuberkulose. Leukemoide reaksjoner er sjeldne. En noe lav hemoglobinverdi (Hb) er ikke uvanlig da normokrom, normocyttær anemi er vanlig ved etablert lungetuberkulose. Leverenzymprøver er ikke sjelden avvikende ved moderat til langt fremskreden tuberkulose. Det er viktig å ha sikre utgangsverdier før behandling startes. Kreatininverdien er viktig å kjenne før medikamentell behandling startes. Det er særlig viktig å vite at nyrefunksjonen er normal når etambutol og aminoglykosider (streptomycin, amikasin og andre) brukes.
8.1.5 Følgetilstander etter lungetuberkulose
Før medikamentell behandling av tuberkulose ble tilgjengelig, var følgetilstander etter torakal tuberkulose meget vanlige. Tuberkuløst empyem var vanlig etter pneumothoraxbehandling (kollapsbehandling av lungevev og kaverner). Dette er i dag en sjelden komplikasjon, men kan ses ved at en kaverne rumperer inn i pleurahulen.
Lengrevarende tuberkuløst empyem kan gi amyloidose som påvises ved rektum-, lever- eller nyrebiopsier.
Tuberkuløs laryngitt kan utvikles hos pasienter som har lungetuberkulose med mange bakterier. Heshet, hoste og svelgningssmerter er vanlige symptomer (Rieder, 2009).
Sekvele etter lungetuberkulose kan gi lungefibrose og i enkelte tilfeller utvikling av cor pulmonale. Forkalkninger av perikard kan også gi hjertesvikt ved volumbelastning, altså konstriktiv perikarditt.
Rest-hulrom etter kaverne kan bli kolonisert med Aspergillus fumigatus som ofte danner et ”ball”-aspergilom. Hemoptyser er ikke uvanlige ved denne tilstanden.
8.2 Tuberkulose utenfor lungene
Tuberkulose utenfor lungene gir symptomer avhengig av hvilket organ som er angrepet. Halsglandler, ledd- og ryggsmerter, pleurale smerter og uforklarlig feber kan være tuberkulose. Ekstrapulmonal tuberkulose skal behandles med samme medikamenter som lungetuberkulose. (se 3. Tuberkulose globalt og i Norge)
8.2.1 Pleuritt
I våre dager sees tuberkuløs pleuritt nesten utelukkende hos personer fra land med høy forekomst av tuberkulose. Pasienter fra slike land med symptomer fra pleura må følges opp intensivt for å få stilt en diagnose. Behandlingsforsøk med tuberkulostatika bør overveies hvis diagnosen ikke sikres. Tuberkuløs pleuritt oppstår vanligvis under ett år etter at smitte har funnet sted hos barn og som post-primær tuberkulose hos voksne. Sykdommen starter som en hypersensitivitetsreaksjon. Ofte finnes et fåtall bakterier i pleuravæsken, som kommer fra et lungefokus inntil pleura.
Symptomer er slapphet, feber og pleural smerte som tilkommer etter et par uker. Infeksjonen, kalt ”tørr pleuritt”, kan helbredes spontant, men i 2/3 av tilfellene tilkommer pleuravæske. Smerten forsvinner ikke alltid når væsken tilkommer, og skyldes inflammasjonen i den nerveførende parietale pleura. Tuberkuløs pleuritt er nesten alltid ensidig.
Diagnosen må mistenkes ved alle uklare pleuritter og røntgenologisk påvist pleuravæske. Sikker diagnose stilles ved adekvat undersøkelse av pleuravæske og hvis mulig pleurabiopsi. Pleuravæsken viser et eksudat, ikke sjelden blodig. Protein i pleuravæske er alltid > 30 g/l, ofte > 50 g/l. Glukose og pH i pleuravæske kan være lave, spesielt ved kronisk tuberkuløst empyem. Cellene i væsken er overveiende lymfocytter. Hurtig påvisning av M. tuberculosis-komplekset kan være vanskelig fordi bakterietallet ofte er lavt. Direkte mikroskopi er derfor ofte negativ. Genteknologisk påvisning av M. tuberculosis-komplekset er også ofte negativ fordi pleuravæsken kan inneholde hemningsstoffer. Man bør sende stort volum til diagnostikk, gjerne 40–50 ml pleuravæske, i steril prøvebeholder.
Ved sterk mistanke om tuberkuløs pleuritt bør thorakoskopi utføres for å skaffe flere og bedre prøver til påvisning av mykobakterier dersom undersøkelser (direkte mikroskopi og eventuelle genteknologiske undersøkelser) av pleuravæske har vært negativ. Det er meget viktig at pleurabiopsi sendes raskest mulig til dyrkning, i tillegg til histologisk undersøkelse. ”Blinde” pleurabiopsier med Abrams nål kan påvise granulomer i 50 % av prøvene (40–70%).
En ubehandlet pleuritt ender vanligvis med betydelig pleural fibrose, fortykkelse og sammenvokste pleurablader i sinusområdet. Flateformige forkalkninger utvikles etter flere år og kan gi betydelig reduksjon i lungefunksjonen. Differensialdiagnosen er først og fremst maligne sykdommer og asbestrelatert pleural effusjon. Tuberkuløs pleuritt behandles etter vanlige retningslinjer for tuberkulose.
8.2.2 Hilusadenitt og mediastinal adenitt
Hilusadenitt og mediastinal adenitt er de vanligste røntgenologiske manifestasjoner ved primærtuberkulose hos barn, men kan også ses hos ungdom og voksne. Tuberkulinprøven kan være negativ hos barn, men den er nyttig for å skille tuberkulose fra sarkoidose hos voksne. Tuberkulosebakterier spres lymfatisk fra lungevevet til hilus og mediastinale lymfeknuter.
I de fleste tilfeller vil en primærtuberkulose være asymptomatisk eller forårsake kun en kortvarig, febril episode. Ved postprimær tuberkulose er slik lymfeknutesvulst meget sjelden. Hvis det ikke er symptomer, feber eller unormale standardblodprøver, kan man følge tilstanden ved røntgenundersøkelse av lungene etter 3–6 måneder. Røntgenologisk påvisning av hilusadenitt kan ved tvil verifiseres ved CT-undersøkelse. Bestående hilusadenitt er ikke uvanlig hos yngre voksne fra Afrika og Asia, og skyldes restfibrose. CT-undersøkelse er ofte nyttig for lymfomutredning. Mediastinoskopi er sjelden indisert.
Differensialdiagnose er sarkoidose (som vanligvis er asymptomatisk) og lymfomer (som gir flere sykdomstegn). Barn skal behandles etter vanlige retningslinjer ved tuberkulose.
8.2.3 Nyretuberkulose
Tuberkulosebakteriene kan spres via blodbanen til nyrene og føre til hematuri og ”steril” pyuri. Spredning med urinen fører til at det kan dannes nye lokalisasjoner i nyrebekken, ureter og urinblære. Fibroseutvikling kan gi strikturer med avløpshinder på ulike nivå. Symptomene er ofte hyppig og sviende vannlating, lyskesmerter og smertefri hematuri. Diagnosen stilles ved mikroskopisk undersøkelse av sentrifugert urin som viser økt antall hvite blodlegemer, mens vanlig bakteriologisk undersøkelse av urinen ikke gir vekst av bakterier. Det er viktig å be om dyrkning av mykobakterier i urin, og det anbefales tre morgenurinprøver (midtstrømsprøver á 50-100 ml) i steril prøvebeholder.
8.2.4 Genital tuberkulose
Genital tuberkulose er i dag sjelden og ses oftest sammen med nyre-/urinveistuberkulose. Sykdommen kan hos menn også spre seg retrograd direkte fra urinveiene via prostata. Hos menn finner man vanligvis epididymitt og orkitt med ømhet, og skrotal oppsvulming. Hematospermi ses i enkelte tilfeller. Hos kvinner er det en hematogen spredning til genitalia. Hos kvinner er metroragier eller amenore vanligst, og dette forårsaker ofte infertilitet ved tubar stenose og bekkenbetennelser. Diagnose stilles ved dyrkning av urin eller materiale skaffet ved inngrep som utskraping eller nåleaspirat (biopsi). Blodprøven CA-125 er økt både ved malign og tuberkuløs ovarie-affeksjon og kan ikke brukes differensialdiagnostisk (Davies et.al., 2008).
8.2.5 Tuberkulose i perifere lymfeknuter
Lymfeknutetuberkulose er sjelden andre steder enn på halsen og ses i dag nesten bare hos yngre personer fra land med høy forekomst av tuberkulose.
Symptomer er en langsomtvoksende, ikke øm oppsvulming av enkelte lymfeknuter foran og bak på halsen. Fistel kan opptre spontant eller etter diagnostisk inngrep. Det er viktig å sende prøve både til dyrkning med henblikk på mykobakterier, og til histologisk undersøkelse. Puss, helst også biopsi, tas over på en steril prøvebeholder og sendes så raskt som mulig til direkte påvisning (mikroskopi eller PCR) og dyrkning. Biopsier tilsettes et par dråper sterilt, fysiologisk saltvann for å hindre uttørring.
Hos norske småbarn skyldes en vedvarende lymfadenitt på hals eller ved kjeve nesten alltid non-tuberkuløse mykobakterier (NTM, atypiske mykobakterier), og pasienten anbefales henvist til øre-nese-hals-poliklinikk (kapittel 12).
8.2.6 Bein- og leddtuberkulose
Bein- og leddtuberkulose kan gi omfattende destruksjon før diagnose stilles, og infeksjonen kan også spres til omliggende bløtdeler, av og til med dannelse av en ”kald abscess” (”senkningsabscess”). Bein- og leddtuberkulose er i dag ikke uvanlig hos personer fra land med høy forekomst av tuberkulose. Fistler er heller ikke uvanlige. Vanligste presentasjon er lokal smerte med tilstivning og bevegelsesinnskrenkning. Langvarige smerter i rygg, hofter og knær hos unge personer fra land med høy forekomst av tuberkulose bør medføre utredning med CT eller MR. Hyppigst affiseres columna og vektbærende ledd (spondylodiskitt, coxarthritt, gonarthritt).
Tidlige røntgenfunn i columna er redusert høyde av mellomvirvelskiven og erosjon i dekkplaten. Etter hvert inntrer destruksjon og kollaps av vertebra og dannelse av en paravertebral abscess. Større ledd svulmer opp, og røntgenundersøkelse viser osteoporose med subchondral erosjon, eventuelt med sekundær reaktiv sklerose og forkalkning.
Diagnose stilles mikrobiologisk med direkte påvisning (mikroskopi eller PCR) og dyrkning av aspirat eller biopsimateriale. Prøven sendes til laboratoriet i steril prøvebeholder. Etter diagnose og under behandling bør pasienten instrueres i å unngå belastninger (løft og lignende) for å unngå ytterligere sammenfall av knokkelvev.
8.2.7 Hudtuberkulose
Hudtuberkulose er uvanlig, og diagnosen er oftest stilt histologisk. Skrofulose som var vanlig i eldre tider, skyldes fistuløst gjennombrudd fra lymfeknuter med sekundære hudforandringer og skrumpning med inndragninger. Diagnosen stilles ved hudbiopsi til direkte påvisning (mikroskopi eller PCR) og dyrkning. Biopsier i sterile prøvebeholdere tilsettes et par dråper fysiologisk saltvann for å hindre uttørking.
8.2.8 Disseminert (miliær) tuberkulose
Disseminert tuberkulose er en tilstand hvor blodbåret spredning av tuberkulosebakterier fører til affeksjon av mange organer i kroppen.
Sykdommen ses vanligvis hos personer med nedsatt immunitet, spesielt hiv-infeksjon (se 6. Økt risiko for smitte og sykdom).
Hos barn starter sykdommen ofte med en akutt eller subakutt febril sykdom. Hos voksne starter tilstanden snikende, med slapphet, anoreksi, vekttap og feber (nattesvette). Lungesymptomer er uvanlige eller lite fremtredende. Hos enkelte finner man lymfadenopati, hepatomegali og splenomegali. Ved miliær tuberkulose kan forskjellige bloddyskrasier (10 %) forekomme, fra aplasier til leukemoide og polycytemiske varianter. Hyponatremi er beskrevet i inntil 11 % av pasientene med tuberkulose.
Diagnose kan være vanskelig. Indusert sputum, ekspektorat, vevsbiter, urin og blod bør sendes til direkte mikroskopi og dyrkning. Blod bør tas på spesialflasker for mykobakterier og oppbevares i romtemperatur. Leverbiopsi viser granulomer i opptil 75 % av biopsiene (Davies et.al., 2008). På lungerøntgen kas en se utbredte millimeterstore ”miliære” (lat.milium, hirse) lesjoner.
8.2.9 Tuberkuløs meningitt
Dette kan være et resultat av hematogen spredning, men kan også oppstå hvis et kaseøst fokus rumperer subaraknoidalt. Fra meningeale lokalisasjoner sprer tuberkulosebakterier seg til cerebrospinalvæsken. Meningene dekkes etter hvert av et ”gelatinøst” eksudat med lymfocytter, fibrin og nekrotiserte tuberkler og bakterier. Eksudatet kan gi hydrocefalus og affeksjon av hjernenerver. Hos barn har tuberkuløs meningitt fortsatt 50 % letalitet. Tuberkuløs meningitt inndeles i tre faser. Prodromalfasen varer i 2–3 uker med sykdomsfølelse, hodepine og personlighetsforandringer. Den meningittiske fasen karakteriseres av meningisme, økende hodepine, oppkast og konfusjon. I den paralytiske fasen ser man rask forverring til koma, kramper og hemiparese. Øyenbunnsforandringer kan observeres med karakteristiske gulaktige korn med størrelse som 1/4 av papillen.
Spinalvæske skal tas til biokjemisk undersøkelse, direkte påvisning (mikroskopi eller PCR) og dyrkning før et tidlig terapeutisk forsøk med tuberkulostatika (se også 11. Non-tuberkuløse mykobakterier (NTM) ). Det bør sendes minst 2 ml spinalvæske i steril prøvebeholder. Økt prøvevolum gir økt sensitivitet, om mulig er 8-10 ml ønskelig. Se spesiallitteratur (Thwaites et.al., 2009).
8.2.10 Gastrointestinal tuberkulose
Hele gastrointestinaltrakten kan rammes, men svært sjelden perianalt og i øvre del av gastrointestinaltrakten (3% av gastrointestinal tuberkulose) (Murkherjee 1979). Ca 1/3 av tilfellene presenterer seg som akutt abdomen, halvparten med smerte i høyre fossa iliaca som ved akutt blindtarmbetennelse og halvparten med klinikk som ved tarmobstruksjon (Klimach 1985). 2/3 har gradvis økende symptomer med feber, sykdomsfølelse, magesmerter, vekttap. Ascites kan forekomme. Ved uavklart sykdomsbilde bør det tas biopsi fra affiserte lymfeknuter eller affisert tarm til tuberkulosedyrkning, og direkte påvisning ( mikroskopi og PCR). Hvis biopsi er tatt og lagt på formalin før tuberkulose ble mistenkt kan man gjøre direkte mikroskopi og PCR.
- For infeksjon med hiv, se 6. Økt risiko for smitte og sykdom
8.3 Mikrobiologisk diagnostikk
Bakteriologisk undersøkelse er den viktigste metoden for diagnostikk av tuberkulose og kontroll av behandlingseffekt. Det er derfor viktig at helsepersonell kjenner til hvordan prøver skal tas og sendes til mikrobiologisk laboratorium for å sikre en bakteriologisk diagnose.
8.3.1 Generelt om mykobakterier
Mykobakterier omfatter en rekke forskjellige arter som kan inndeles i to hovedgrupper:
- Mycobacterium tuberculosis-komplekset: Human tuberkulose forårsakes av arter som tilhører Mycobacterium tuberculosis-komplekset (Mycobacterium tuberculosis, M. bovis, M. africanum,). Nesten alle infeksjoner i Norge er forårsaket av M. tuberculosis.
- Non-tuberkuløse mykobakterier (NTM): Mykobakteriearter som ikke tilhører Mycobacterium tuberculosis-komplekset, omtales ofte som atypiske mykobakterier. Nå brukes betegnelsen NTM (non-tuberculous mycobacteria), mens MOTT (mycobacteria other than tubercle bacilli) ble tidligere benyttet. En del av disse artene er potensielt sykdomsfremkallende hos mennesker. I Norge er de viktigste i så henseende Mycobacterium avium og M. intracellulare, M. abscessus, M. chelonae, M. malmoense, M. kansasii, M. bohemicum og M. marinum. M. avium og M. intracellulare inngår i betegnelsen M. avium-komplekset (MAC).
Mykobakterier er syrefaste, aerobe, ikke-sporedannende, ubevegelige stavbakterier. M. tuberculosis er rette eller lett bøyde, 0,2 – 0,6 x 1,0 – 10,0 µm i størrelse, og vokser langsomt. Det kan ta fra to til åtte uker før det kommer synlig vekst på inokulerte dyrkningsmedier (Jenkins, 1998).
8.3.2 Sikkerhet
Helsepersonell kan bli utsatt for tuberkulosesmitte ved pasientkontakt og ved håndtering av laboratorieprøver. Risikoen for dette er størst i laboratorier der man dyrker mykobakterier, men den er også i høy grad tilstede ved prøvetaking. Dette gjelder spesielt når pasienten hoster, blant annet når det tas indusert sputum. For å beskytte seg mot smitte skal helsepersonell under slike prosedyrer benytte smittefrakk med lange ermer, hansker, åndedrettsvern ( P3-munnbind), visir eller beskyttelsesbriller. Prøvetakingen bør foregå i eget rom med egnet ventilasjon (negativt trykk). Ved søl må godkjente desinfeksjonsmidler benyttes. En må unngå søl av prøvemateriale på utsiden av prøvebeholderen (Arbeids- og administrasjonsdepartementet, 2002; Pfyffer et.al., 2007).
- Se også 7. Smitteverntiltak.
8.3.3 Prøvetaking
Generelt
Det er svært viktig at det tas adekvate prøver til påvisning av mykobakterier før antituberkuløs behandling starter. Alle typer prøvemateriale kan innsendes til dyrkning og direkte påvisning. Prøvene sendes til laboratoriet raskest mulig.
Prøven bør tas på en slik måte at man unngår tilblanding av andre mikrober. Penselprøver bør brukes i minst mulig utstrekning, fordi det gir utilstrekkelig prøvemengde. Prøvene skal ikke tilsettes noen form for konserveringsmiddel. Steril, tett engangs plastikkbeholder skal benyttes. Egen ferdig utfylt rekvisisjon for mykobakterieundersøkelser sendes med prøvene.
Antall ekspektoratprøver
Ekspektorat er den viktigste prøvetype ved mistenkt lungetuberkulose. Antallet prøver som er nødvendig avhenger av situasjon og formål.
I spesialisthelsetjenesten, ved klinisk mistanke om TB, bør det tas minst tre dyrkningsprøver av sputum, hvorav minst én morgenprøve (se prosedyre under), for å kunne utelukke TB. For å vurdere smittsomhet i denne situasjonen er det tilstrekkelig med direkte mikroskopi eller PCR av to sputumprøver.
I en screeningsituasjon på mottak, der det ikke er spesiell mistanke om TB, bør det tas minst to dyrkningsprøver av sputum, hvorav minst én morgenprøve, for å kunne utelukke TB. For å vurdere smittsomhet i denne situasjonen, er det tilstrekkelig med PCR (f.eks GeneXpert) av én prøve eller direkte mikroskopi av to sputumprøver (forutsatt god prøvekvalitet).
Prosedyre for høsting av ekspektorat / indusert sputum
Kvaliteten av en ekspektoratprøve må vurderes av både av prøvetaker og på laboratoriet. Rekvirent bør vurdere ekspektoratprøver makroskopisk med tanke på kvalitet før de sendes til laboratoriet. Ved dårlig prøvekvalitet (prøver med vandig utseende tilsvarende spytt) bør ny prøve tas. Selv om sensitiviteten for påvisning av mykobakterier i prøver som ser ut som spytt er betydelig lavere enn for prøver fra nedre luftveier, er det vist at mykobakterier kan påvises i disse prøvene. Laboratoriene bør derfor ikke avvise ekspektoratprøver, men gi tilbakemelding til rekvirent om at prøven er av dårlig kvalitet.
- Fastende morgenprøve bør tas straks man står opp. Prøven tas før mat/drikke/røyk/tannpuss og uten å skylle munnen med vann.
- Ved on-the-spot-prøve bør det ikke være matrester i munnen. Faste er ingen forutsetning for å ta prøven. Ved behov for å skylle munnen før prøvetakning bør sterilt vann brukes.
Ved sputumprøve må pasienten må instrueres om å hoste opp fra brystet (helst 5–10 ml). For å få dette til kan det hjelpe å puste dypt inn flere ganger, deretter hoste opp og spytte direkte i prøveglasset. Kanten på prøveglasset bør holdes under underleppen slik at utsiden av glasset ikke tilsøles.
Indusert sputum innebærer inhalasjon av sterilt hypertont saltvann (konsentrasjoner på 3% og 4.8% er i bruk og regnes som likeverdige) ved hjelp av et forstøverapparat kan ofte få pasienten til å produsere ekspektorat. Det bør angis på rekvisisjonen at prøven er indusert. Metoden kan brukes så vel diagnostisk som til kontroll av behandlingen.
- Helse Bergen: Fagprosedyre for indusert sputum (Helsebiblioteket.no)
- Helse Fonna: Indusert sputum. Film på 21 språk. Kan vises før undersøkelsen (YouTube.com)
Hos pasienter som ikke klarer å avgi en god ekspektoratprøve, ikke engang med indusert sputum, kan det være nødvendig med en bronkialskylleprøve etter installasjon av fysiologisk saltvann gjennom bronkoskop. Minst 5 ml væske oppsamles.
Larynxavstryk
Larynxavstryk ble en del benyttet tidligere, men bør ikke lenger brukes på grunn av smitterisiko for helsepersonellet. Indusert sputum bør heller brukes hvis det er vanskelig for pasienten å avgi ekspektorat.
Ventrikkelskyllevæske
Gastrisk aspirat anbefales som hovedmetode hos små barn (< 10–12 år) som ikke klarer å avgi en god ekspektoratprøve (se 6. Økt risiko for smitte og sykdom). Det bør tas tre prøver: én prøve hver dag på tre påfølgende dager. Prøven skal tas rett etter oppvåkning om morgenen, minst åtte timer etter siste måltid.
- Pasienten sederes lett, eksempelvis med midazolam.
- Nasogastrisk sonde plasseres. Klinisk/auskultatorisk plasseringskontroll.
- Mageinnholdet aspireres i en 50 ml sprøyte og overføres til en steril beholder.
- 50–75 ml sterilt vann (ikke saltvann) settes ned på sonden, hvoretter det påny aspireres. Dette aspiratet tilsettes det første.
- Nøytraliser oppsamlet væske med Natriumbikarbonat 0,5 mmol/ml til pH 7 (urinstix).
- Materialet sendes til mikrobiologisk laboratorium for direkte påvisning (mikroskopi eller PCR) og dyrkning med resistensbestemmelse.
Urin
Morgenurin skal anvendes. En midtstråleprøve oppsamles i steril prøvebeholder (50-100 ml). Det bør tas minst tre prøver: én prøve hver dag på tre påfølgende dager.
Puss og sekret
Så mye representativt prøvemateriale som mulig aspireres og tas over på en steril prøvebeholder. Penselprøve bør bare benyttes dersom aspirasjon ikke er mulig.
Ved mistenkt lungetuberkulose kan perkutan finnålsaspirasjon av perifert beliggende infiltrater eller rundskygger være en nyttig undersøkelse. Det er viktig at materialet (i tillegg til eventuell cytologisk undersøkelse) sendes til dyrkning på mykobakterier og direkte påvisning (mikroskopi eller PCR). (Dette må presiseres på egen rekvisisjon som sendes med prøven.)
Prøvetaking fra lymfeknuter
Det er viktig at diagnostikken ikke blir forsinket pga utilstrekkelig prøvemateriale. Det kan være vanskelig å få nok materiale til både cytologi og mikrobiologiske analyser (dyrkning og mikroskopi/ PCR) ved finnålsaspirasjon. Behandlende lege har ansvaret for å be om biopsi hvis finnålsaspirasjonen ikke avklarer diagnosen. Dersom mikroskopi /PCR er negativ og dyrkning er negativ etter 2-3 uker, kan det være riktig å gå videre til vevsbiopsi uten å vente 6-8 uker på endelig dyrkningssvar. Avhengig av klinisk situasjon kan det i noen tilfeller være en bedre løsning å gå rett på lymfeknuteekstirpasjon eller vevsbiopsi, etter avtale med øre-nese-hals- lege eller kirurg.
Vevsbiter (biopsi og obduksjonsmateriale)
Vev (helst 1 g eller mer) fjernes aseptisk og legges i steril beholder uten tilsetningsvæske. Tilsett et par dråper sterilt, fysiologisk saltvann for å hindre uttørking.
Kroppsvæsker (spinalvæske, pleuravæske osv.)
Kroppsvæske som for eksempel spinalvæske samles aseptisk i en steril prøvebeholder eller i sprøyte som lukkes med egen propp (må ikke innsendes med påsatt kanyle). Fordi antall bakterier kan være lavt og ujevnt fordelt vil dyrkning av et stort prøvevolum (minst 2-3 ml spinalvæske) øke sjansen for å påvise mykobakterier.
8.3.4 Transport av prøvemateriale
Prøvebeholderen må merkes med pasient-identifikasjon, prøvetype, dato og tidspunkt for prøvetaking. Påfør kliniske opplysninger på rekvisisjonen. Dette kan være avgjørende for at prøven blir undersøkt på best mulig måte. Angi hvilke undersøkelser som ønskes utført (direkte mikroskopi, genteknologisk påvisning, dyrkning). Det er viktig at man angir at prøven skal undersøkes med henblikk på mykobakterier. Disse prøvene behandles på en helt annen måte i laboratoriet enn prøver som innsendes til vanlig bakteriologisk dyrkning.
Prøvene må transporteres så raskt som mulig til laboratoriet for å unngå mykobakteriedød og overvekst av andre mikroorganismer. Prøvene skal oppbevares i kjøleskap dersom det tar over én time før prøvene kan sendes eller undersøkes i laboratoriet.
Prøvene skal ikke utsettes for dagslys. Tuberkulosebakterier er meget ømfintlige for ultrafiolette (UV) stråler. Hvis prøvene ikke skjermes for UV-lys, vil en kunne få falskt negative resultater. Prøvebeholdere med materialer må derfor ikke stå fremme, men straks plasseres i transportemballasjen.
Forsendelse må skje i henhold til postverkets regler. NB: Husk tett ytterbeholder i slagfast plast. Det er viktig at prøvematerialet ikke forurenser prøvebeholderens utside og at korken på prøvebeholderen skrus godt igjen.
8.3.5 Laboratorieundersøkelser
Resultat av undersøkelsene
Laboratorieresultat må alltid sammenholdes med pasientens kliniske bilde. Falskt positive dyrkningsresultater kan forekomme som følge av kontaminering, og det er derfor viktig at spesialisten tar kontakt med laboratoriet dersom det ikke er samsvar mellom laboratoriets resultat og den kliniske vurderingen. (Dahle et.al., 2002). Man kan også få negativt prøvesvar hos en pasient med tuberkulose dersom prøvetaking eller transport ikke har vært optimal. Det er viktig at kommunikasjonen mellom behandlende lege og det mikrobiologiske laboratoriet er god.
Direkte påvisning (mikroskopi og PCR)
Direkte påvisning av M.tuberculosis-komplekset i luftveismateriale er viktig for rask diagnose og for å identifisere de mest smittsomme pasientene. Det er derfor viktig at spesialisten alltid rekvirerer denne undersøkelsen ved mistanke om lungetuberkulose. Direkte mikroskopi utføres ved mikrobiologisk laboratorium og ved enkelte infeksjonsavdelinger. Noen laboratorier utfører først PCR og mikroskoperer de prøvene hvor M.tuberculosis-komplekset er påvist. (PCR har en høyere sensitivitet enn mikroskopi av luftveismateriale). Direkte mikroskopi blir utført med klassisk Ziehl-Neelsens fargemetode og/eller med forbedret metode (auramin-rhodamin og UV-lys). Undersøkelsen er imidlertid lite sensitiv. Man regner vanligvis med at 5 000–10 000 bakterier per ml ekspektorat er nødvendig for at tuberkulosebakterien (syrefaste staver) skal kunne påvises ved direkte mikroskopi. Positiv direkte mikroskopi er derfor et uttrykk for at en pasient er smittsom. Ulempen med metoden er at den ikke skiller mellom M. tuberculosis-komplekset og andre mykobakterier.
Mykobakterier kan påvises ved hjelp av ulike genteknologiske metoder, hvorav polymerasekjedereaksjon (PCR) er den vanligste. PCR er svært følsom, og nedre deteksjonsgrense for positiv PCR er ca 10 bakterier. Fordelen med PCR er at man raskt kan påvise M. tuberculosis-komplekset med høy sensitivitet direkte i prøvematerialet og at man dermed kan skille mellom infeksjon forårsaket av M. tuberculosis-komplekset og andre mykobakterier (12). PCR-metoden kan kombineres med DNA-sekvensering eller hybridisering slike at ulike arter eller rifampicin-resistens skal kunne påvises, direkte i prøvematerialet eller i kultur. Metodene kan brukes på ekspektorat, materiale fra bronkoskopi, samt gastrisk aspirat og enkelte andre prøver. Andre prøvematerialer analyseres imidlertid også ved PCR. Tilbud om PCR-påvisning av M. tuberculosis-komplekset finnes ved de fleste regionsykehus og enkelte andre medisinsk-mikrobiologiske laboratorier. Det er viktig å være klar over at PCR ikke skiller mellom levende og døde mikroorganismer. Falsk positiv PCR forekommer, men sjeldent.
Dyrkning
Dyrkning av mykobakterier er viktig av flere grunner, ikke minst fordi metoden er mer sensitiv enn direkte mikroskopi og PCR, idet nedre deteksjonsgrense for dyrkning er cirka 10 bakterier/ml. Dyrkning er også nødvendig for å kunne utføre resistensbestemmelse og for å kunne utføre typing av pasientens stamme (se nedenfor). Tuberkulosebakteriene vokser langsomt slik at det kan ta opp til seks uker før det kommer oppvekst ved dyrkning. Av denne grunn er det nødvendig med en forsiktig dekontaminering av luftveisprøvene i laboratoriet for å hindre overvekst av bakterier fra normalfloraen. Fra prøver med stor mengde mykobakterier kommer det vanligvis raskere vekst enn fra prøver med få bakterier.
De fleste laboratorier i Norge benytter flytende medier for dyrkning av mykobakterier, mens det eventuelt parallelt utføres dyrkning på faste medier (Løwenstein Jensen-medium) for å sikre påvisning av alle mykobakterie-arter. En av fordelene med flytende medier er at vekst av mykobakterier kan påvises tidligere her enn på faste medier, ofte i løpet av 1–2 uker.
Identifikasjon av mykobakterier i kulturer
Ved oppvekst av mykobakterier i laboratoriet er en rask identifikasjon viktig for å skille mellom M. tuberculosis-komplekset og andre mykobakteriearter. Først utføres mikroskopi av kulturen for å bekrefte (eller avkrefte) at veksten utgjøres av syrefaste stavbakterier. Videre identifikasjon av syrefaste staver utføres ved noen få større laboratorier i Norge.
Ut fra makro- (ved vekst på fast medium) og mikroskopisk utseende kan man ofte med relativt stor sikkerhet avgjøre om stammen tilhører M. tuberculosis-komplekset eller en annen mykobakterie. Spesielt i kultur har artene i M. tuberculosis-komplekset en tendens til parallell sammenklumping, noe som kan observeres mikroskopisk (fenomenet kalles ”cord factor”). En rask identifikasjon av stammer i M. tuberculosis-komplekset blir nå i stor utstrekning gjort ved påvisning av et spesifikt protein, MPT64 antigen, som tuberkulosebakteriene utskiller under vekst. Men identifikasjon gjøres også med hybridisering med spesifikke DNA-prober (AccuProbe, GenProbe), PCR (Roche) eller PCR kombinert med DNA-sekvensering. Med DNA-prober kan stammer av M. tuberculosis-komplekset og M. avium-komplekset (MAC) identifiseres i løpet av meget kort tid (timer). Hvis man ser bort fra vaksinerelaterte infeksjoner med M. bovis BCG, vil 99.9 % av stammer i dette komplekset være M. tuberculosis her i Norge. Andre mer sjeldent forekommende NTM-arter identifiseres med genteknologiske metoder (for eksempel artsspesifikk PCR-test eller 16SrRNA-gensekvenseringsteknikk) og biokjemiske metoder.
Molekylærepidemiologisk karakterisering av M. tuberculosis-stammer
Resistensbestemmelse
For å sikre riktig behandling av pasienter med tuberkulose er det helt nødvendig at man kjenner M. tuberculosis-stammens følsomhet overfor tuberkulosemedikamenter. Resistensbestemmelse mot rifampicin, isoniazid, streptomycin, etambutol og pyrazinamid (1. linjemedikamenter) utføres derfor alltid når det foreligger positive dyrkningsprøver hos en ubehandlet pasient og ved mistanke om behandlingssvikt. Metoden er kompetansekrevende og er etablert bare ved svært få av de større laboratoriene. Ved påvist resistens utføres undersøkelse med 2. linjemedikamenter. Utvidet resistensbestemmelse utføres kun på Nasjonalt referanselaboratorium ved Folkehelseinstituttet i henhold til internasjonale anbefalinger.
Vanligvis vil det ta 2–3 uker fra det har kommet oppvekst av tuberkulosebakterier til svar på resistensbestemmelse foreligger. Forsendelse av kultur til annet laboratorium – og eventuelt behov for ny subkultur før videre undersøkelse – kan forlenge svartiden. Genteknologisk metode for påvisning av mutasjoner assosiert med rifampicinresistens (påvisning av mutasjoner i RNA polymerase genet (rpoB genet)) kan utføres direkte i prøvematerialet eller på kultur. Dette kan utføres i løpet av timer eller 1–2 dager, avhengig av hvilken metode som benyttes, og utføres ved noen av de større laboratoriene i landet . Ulike metoder er i bruk, men alle påviser mutasjoner i rpoB genet vha PCR etterfulgt av sekvensering, oligohybridisering eller benyttelse av GenXpert systemet. Denne påvisningen er viktig, fordi rifampicinresistens er markør for multiresistens. Det påvises imidlertid svært få tilfeller av multiresistent tuberkulose i Norge.
8.3.6 Laboratorier
Mikroskopi med hensyn på mykobakterier utføres ved rundt 20 av de medisinsk-mikrobiologiske laboratoriene i landet. Dyrkning og eventuell genteknologisk påvisning av mykobakterier utføres ved 10 av disse. Alle M. tuberculosis-isolat skal sendes umiddelbart til Folkehelseinstituttet for gjennomføring eller bekreftelse av identifikasjon, resistens og molekylærepidemiologisk testing. Identifikasjon og resistensbestemmelse utføres også ved noen regionlaboratorier. Alle M. tuberculosis-isolat i Norge oppbevares i en nasjonal stammebank ved Folkehelseinstituttet.
Kvalitetssikring
Det er viktig at alle laboratorier har et godt opplegg både for intern og ekstern kvalitetssikring av mykobakteriediagnostikken.
- Direkte mikroskopi: Preparat bør helst oppbevares til resultat av dyrkning foreligger. På den måten kan preparatet undersøkes på nytt dersom det ikke er samsvar mellom resultat av mikroskopi og dyrkning (for eksempel positivt ved mikroskopi og dyrkningsnegativt). Det bør være rutine for kontinuerlig sammenligning av mikroskopi- og dyrkningsresultat. Alle laboratoriene i Norge deltar i et nasjonalt eksternt kvalitetssikringsopplegg for landets mikrobiologiske laboratorier, samtidig som store laboratorier også deltar i internasjonal kvalitetssikring.
- Dyrkning: Dersom det kommer oppvekst av samme bakteriestamme i prøver fra forskjellige pasienter, og disse prøvene har vært behandlet i laboratoriet på samme dag, må man tenke på muligheten for laboratorieforurensing. Dette kan avklares ved hjelp av ”fingeravtrykksundersøkelser” (Dahle et.al., 2009; Balasingham et.al., 2009). Det bør også føres en oversikt over antall prøver som har vært bakterielt forurenset (vanligvis < 4%). Dette kan gi en indikasjon på om dekontamineringsprosessen fungerer etter hensikten. Ekstern kvalitetssikring av dyrkning skal inngå i det nasjonale, eksterne kvalitetssikringsopplegget.
- Resistensbestemmelse: En viss andel av undersøkelser utført ved andre laboratorier gjentas ved Folkehelseinstituttet. I tillegg deltar de laboratorier som utfører resistensbestemmelse, i et eksternt kvalitetssikringsopplegg med standard stammepaneler fra WHO, organisert via Folkehelseinstituttet.
8.4 Tuberkulinprøve
Tuberkulinprøvens viktigste anvendelse er å kunne påvise om et individ er smittet med tuberkulosebakterier. En positiv tuberkulinprøve betyr at personens immunforsvar har reagert mot visse antigener fra mykobakterier. Denne reaksjonen kan være en følge av smitte med tuberkulosebakterier, atypiske mykobakterier eller gjennomgått BCG-vaksinasjon.
Tuberkulinprøven er en grov metode med mange feilkilder.
8.4.1 Tuberkulin
Tuberkulin er et konsentrat laget av en flytende kultur av M. tuberculosis. Det inneholder en blanding av ulike protein- og karbohydratantigener. Tuberkulin laget etter Robert Kochs originale metode blir kalt Old tuberculin (OT). På 1930-tallet laget Seibert et renset proteinprodukt som ble kalt Purified Protein Derivate (PPD). Old tuberculin konsentreres ved inndamping, mens PPD produseres ved utfelling av proteiner og senere fortynning. Standarden for tuberkuliner er PPD RT 23 (tilsatt Tween 23). Det ble laget på 1930-tallet og oppbevares ved Statens Serum Institut i København (SSI).
Frem til 1. juli 2004 benyttet man i Norge hudrispeprøven Adrenalin-Pirquet med Old tuberculin laget som Syntestisk Medium Tuberkulin (SMT) (Bjørlo et.al., 1985; Jentoft et.al., 1985; Jentoft et.al., 1999) produsert av Veterinærinstituttet. Fra 1. juli 2004 følger Norge internasjonale anbefalinger og benytter Mantoux-metoden, oppkalt etter den franske legen Charles Mantoux, og standard vil være Purified Protein Derivate: PPD RT 23 SSI med styrke 2 tuberkulinenheter (T.U.) Tuberkulinet settes nå som intrakutan injeksjon.
Tuberkulinet er ferdig blandet og klart til bruk. PPD skal oppbevares i kjøleskap ved 2-8 °C, beskyttet mot lys. Tuberkulinet må benyttes innen utløpsdato. Etter anbrudd må tuberkulinet anvendes innen 24 timer. Det må fortsatt oppbevares mørkt og kjølig.
PPD bestilles fra Folkehelseinstituttet på samme måte som vaksiner. Helsesøstre kan rekvirere PPD jf. Forskrift om legemiddelforsyning m.v. i den kommunale helsetjeneste. Rekvirenten må underskrive på bestilling. Tittel og helsepersonellregisternummer (HPR-nummer)/ID-nummer må angis. Angi hvem som bestiller, leveringsadresse, rekvirentens telefon- og faksnummer og kundenummer. Bestillingen påføres nøyaktig leveringsadresse. Bestillingen sendes per:
- Brev: Folkehelseinstituttet, Vaksineforsyningen, Postboks 222 Skøyen, 0213 Oslo. Merk konvolutten ”vaksinebestilling”.
- Telefaks: 21 07 70 12, Folkehelseinstituttet, Vaksineforsyningen, Postboks 222 Skøyen, 0213 Oslo
8.4.2 Tuberkulinreaksjonen
Tuberkulinreaksjonen er en typisk type IV-reaksjon, også kalt forsinket hypersensitivitet og cellemediert immunitet. Makrofager og Th1-lymfocytter er involvert. Etter tilstrekkelig kontakt med mykobakterier formidler makrofagene den T-cellemedierte immunitetet etter et tidsforløp på 3–4 uker. Det kan derfor ta 3–4 uker fra eksponering til tuberkulinreaksjonen kommer.
Tuberkulinprøving av et ikke-sensibilisert individ induserer ikke positiv tuberkulinreaksjon. uansett hvilket tuberkulin, dose eller hyppighet man tester med. Hos sensibiliserte personer vil det derimot i løpet av tre døgn etter en Mantoux-test fremkomme en hevelse med rødhet omkring. Kraftige tuberkulinreaksjoner kan gi ødem, vesikler og ulcerasjon, og det kan også forekomme slapphet, feber og lymfangitt. Kraftige tuberkulinreaksjoner som krever behandling, er meget uvanlige. Lymfangittstripe kan ses sammen med vesikulære reaksjoner hvor det dannes små blemmer på infiltratet. Ulcerasjoner kan behandles med tørr kompress og tilheler spontant i løpet av et par uker. Antibiotika er ikke nødvendig, og sekundær infeksjon forekommer praktisk talt ikke.
8.4.3 Mantoux-metoden
Utførelse
Dosen er 0,1 ml PPD RT 23 SSI med styrke 2 T.U. (tuberkulinenheter). Samme styrke og dosering gjelder for alle aldersgrupper. Tuberkulinet settes intrakutant. Det benyttes 1 ml findoseringssprøyte med 0,5x16 mm kanyle, som ved BCG-vaksinering. Trekk opp 0,15 ml tuberkulin. Fjern eventuelle luftbobler, og press ut væske slik at kanylen blir fylt og det gjenstår 0,1 ml tuberkulin i sprøyten.
Prøven skal settes på midtre tredjedel av venstre underarms dorsalside (overside) mellom de to langsgående musklene. Unngå områder med arr eller hudsykdommer. Huden vaskes med 70 % alkoholoppløsning. Huden må bli helt tørr før PPD settes. Strekk lett i huden. Nålen legges flatt mot huden i 10–15 graders vinkel med kanylens åpning opp. Stikk inn i øverste hudlag. Injiser 0,1 ml (2 T.U.) langsomt. Trekk nålen raskt ut. Ikke massér innstikkstedet. Tuberkulinreaksjonen kan svekkes hvis tuberkulinet injiseres nærmere håndledd eller albue.
En vellykket injeksjon vil umiddelbart resultere i en papel på 8–10 mm i diameter. Denne papelen vil være synlig i omtrent 10 minutter. Hvis det ikke fremkommer en papel, eller papelen har en diameter mindre enn seks millimeter, kan injeksjonen være satt for dypt eller injeksjonsvæsken kan ha lekket ut og resultatet blir vanskelig å tolke. Da bør testen primært gjentas på motsatt arm eller alternativt på samme arm mer enn 4 cm borte fra første innstikksted. En slik ny test kan settes umiddelbart etter en mislykket test. I løpet av de neste tre døgn vil det hos sensibiliserte personer fremkomme en hevelse med rødhet rundt.

PPD-prøven settes på midtre tredjedel av venstre underarms dorsalside (overside) mellom de to langsgående musklene
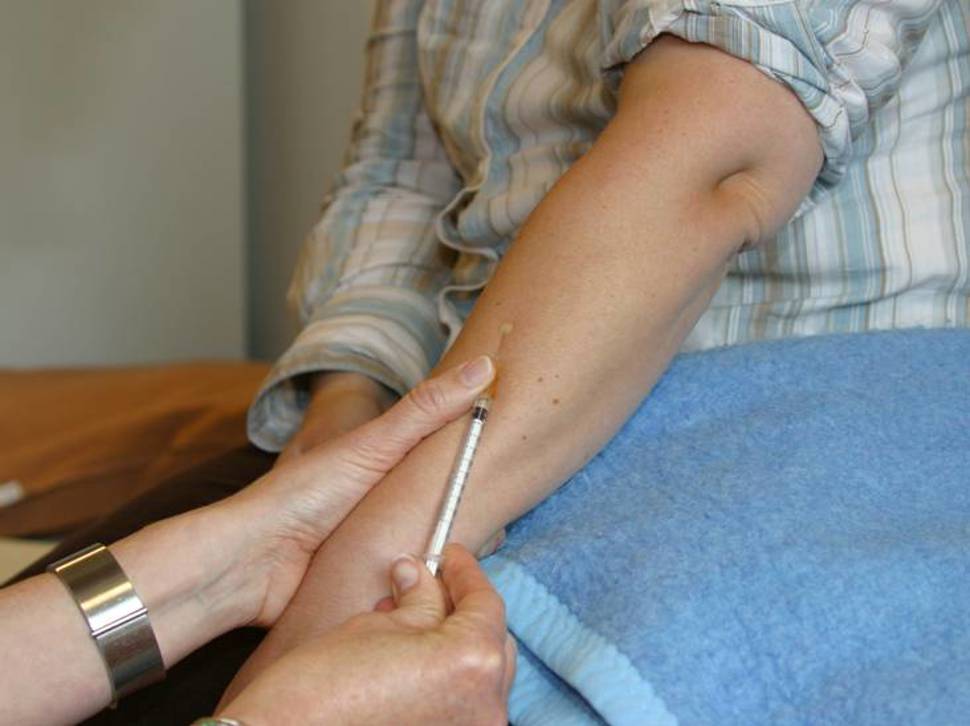
En vellykket injeksjon vil umiddelbart resultere i en papel med diameter på 8–10 mm.
Avlesning
Avlesningen skal skje etter tre døgn (72 timer). Å avlese før 72 timer kan medføre falskt negative tester. Avlesning etter 72 timer er ikke anbefalt. Kun indurasjonen (hevelsen) avleses. Det avleses på tvers av underarmen. Det kan være vanskelig å se start- og avslutninggrensene på en indurasjon. Derfor kan det være nyttig å føle overgangen mellom rubor og indurasjon med fingrene. Indurasjonen er fastere enn den omgivende huden, og den hever seg over hudnivå.
Korrekt avlesning er viktig og krever trening. Undersøkelser fra mange land viser betydelige forskjeller i avlest resultat mellom ulike avlesere og samme avleser ved anonymisert (”blindet”) avlesning. Det er derfor viktig å standardisere avlesningen best mulig gjennom god opplæring av personell som skal utføre tuberkulinprøvingen.
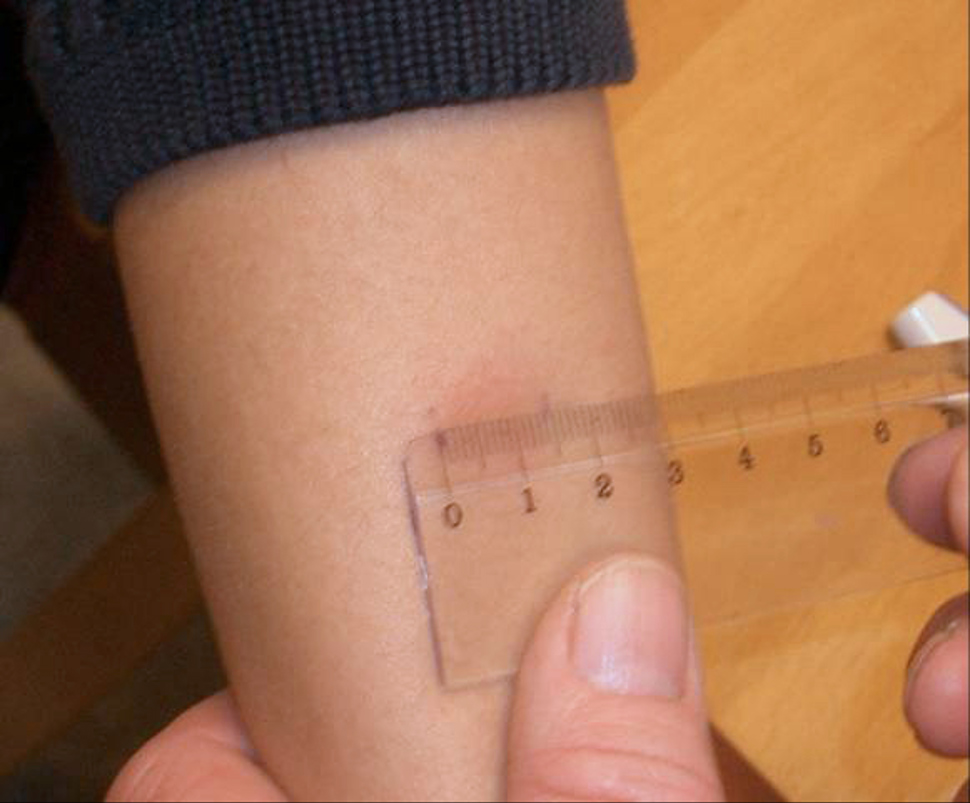
Avlesning skal skje etter 72 timer. Det avleses på tvers av underarmen. Kun indurasjonen avleses.
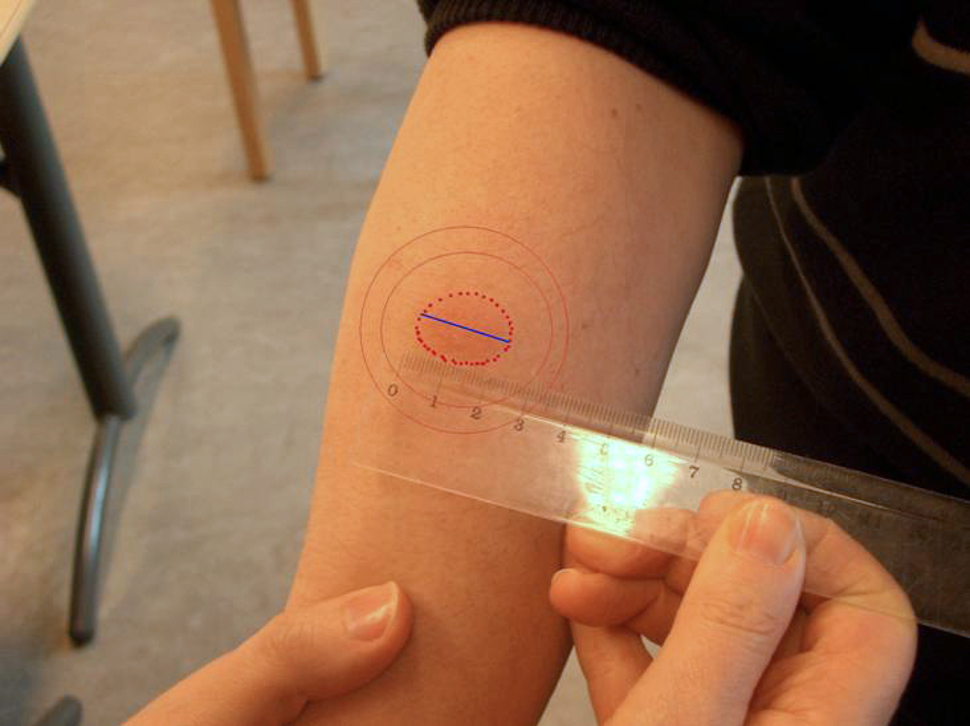
Her anes en stor ruborsone rundt en kraftig reaksjon med indurasjon på 22 mm. Armen skal ikke hvile mot underlaget.
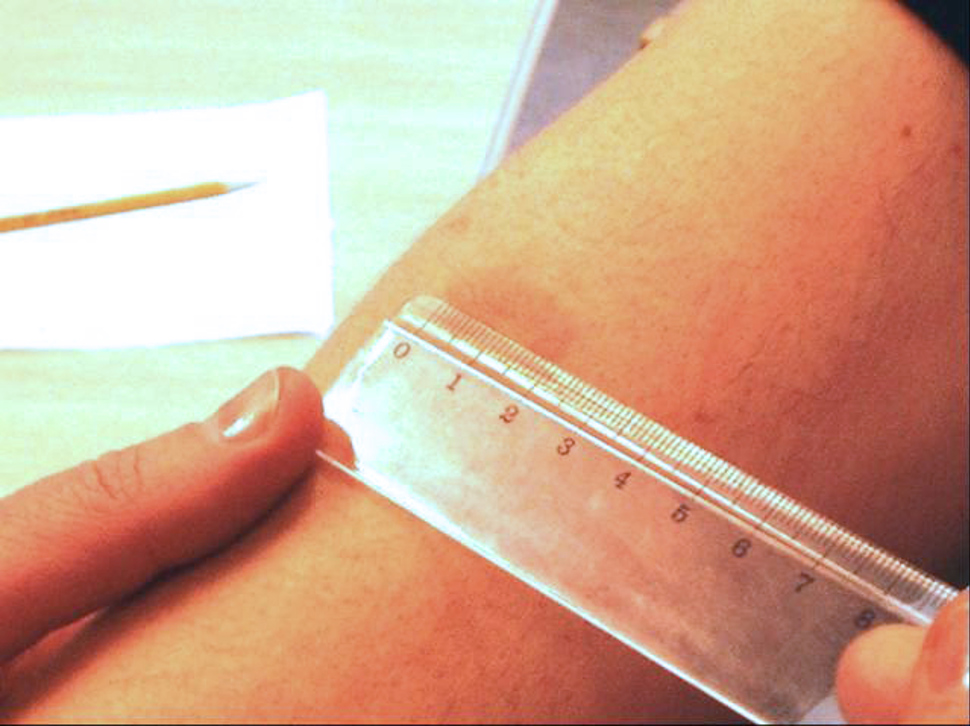
Avlesning krever gode lysforhold.
Dokumentasjon
Resultat av tuberkulinprøven dokumenteres på tuberkulinkort og/eller i journal med settedato, metode (PPD 2 T.U.), batch-nummer, avlest resultat (det vil si største utbredelse av indurasjon i millimeter på tvers av underarmen) og signatur til den som avleser prøven. Resultatet oppgis ikke som positivt eller negativt, men i eksakt antall millimeter, også ved 0 mm. Eksempel:
”01.07.04 – PPD 2.T.U. – (batch-nummer) – 7 mm – 04.07.04 – Anne Olsen”
Vesikuløse eller lymfangitiske reaksjoner markeres med en V eller en L.
8.4.4 Tolkning av tuberkulinresultatet
Etter at tuberkulintesten ble introdusert på slutten av 1800-tallet, har den gjennomgått forbedringer i sammensetning og standardisering. Indikasjonen for bruk har også endret seg etter hvert som tuberkulose i vår del av verden ble mer sjelden. Allmenn screening er erstattet med målrettede undersøkelser i risikogrupper. Klare millimeterdefinisjoner på hva som er positive reaksjoner, er erstattet med mer individuelle vurderinger ut fra forhåndssannsynligheten for at pasienten virkelig er smittet. Det betyr at en reaksjon på et visst antall millimeter kan ha ulik betydning hos for eksempel en norskfødt skoleelev og en somalisk innvandrer. En slik tilnærming er helt nødvendig for at tuberkulintesten skal kunne gi nyttig informasjon, særlig i et samfunn som vårt med lite tuberkulose og en befolkning som er vaksinert med BCG.
Positiv prøve ved Mantoux-test er definert som indurasjon på 6 mm eller mer
En positiv prøve betyr at personen har en hypersensitivitetsreaksjon mot tuberkulin, men betyr ikke nødvendigvis at personen har vært utsatt foren reell tuberkulosesmitte. Grenseverdiene er altså ikke absolutte, og tuberkulinresultatet må alltid vurderes individuelt i forhold til den risiko som foreligger for den enkelte. En positiv tuberkulintest med indurasjon på 6 mm eller mer må derfor alltid vurderes i forhold til:
- kjent eksponering for tuberkuløs smitte
(smittekontakter, opphold i områder med høy forekomst av tuberkulose) - mulighet for en falsk positiv reaksjon
Falske positive reaksjoner vanlig. En positiv tuberkulinreaksjon betyr altså ikke nødvendigvis at en person har tuberkulosesmitte eller -sykdom. Årsakene til disse falskt positive reaksjonene er tidligere gjennomgått BCG-vaksinasjon, infeksjon med atypiske mykobakterier og boostereffekt etter gjentatt tuberkulintesting. En positiv Mantoux reaksjon skal derfor bekreftes av IGRA.
Personer med positiv tuberkulinreaksjon som er bekreftet av positiv IGRA skal eventuelt utredes videre med tanke på latent tuberkulose (se 10. Forebyggende behandling av latent tuberkulose (LTB)).
En negativ tuberkulinreaksjon utelukker ikke tuberkulosesmitte eller -sykdom (falsk negativ tuberkulinreaksjon). Cirka15 % av pasienter med tuberkulosesykdom har negativ tuberkulinprøve. Spesielt eldre personer med alvorlig sykdom og pasienter med immunsvikt kan ha falsk negativ tuberkulinreaksjon.
Personer med symptomer på tuberkulosesykdom skal straks henvises for videre utredning, uavhengig av tuberkulinreaksjonens størrelse. Hos dem er derfor tuberkulinprøve før henvisning mindre viktig.
Gjennomgått BCG-vaksinasjon og hvordan det påvirker tuberkulinreaksjoner
Gjennomgått BCG-vaksinasjon kan påvirke en tuberkulinreaksjon, og dette er avhengig av flere forhold. Viktigst er:
- Alder ved vaksinering
BCG-vaksine gitt i nyfødtperioden påvirker tuberkulinreaksjonen lite. Tuberkulinreaksjonen forsvinner ofte raskt og innen de første fem årene etter vaksinering. BCG-vaksine gitt senere, for eksempel i ungdomsskolealder, vil gi en kraftigere og mer langvarig respons ved tuberkulinprøving. - Tid fra vaksinen ble satt
Tuberkulinreaksjon som følge av gjennomgått BCG-vaksinasjon avtar gradvis i løpet av de første syv til ti årene etter vaksinasjon.
Oppfølging av ulike grupper etter resultat av tuberkulinundersøkelse
En positiv tuberkulintest med indurasjon på 6 mm skal ikke automatisk føre til henvisning for videre utredning hos spesialist. Det må gjøres en individuell vurdering av hvilken risiko som foreligger for den enkelte testede. Denne vurderingen må blant annet også baseres på den testedes alder, tidligere BCG-vaksinasjon og sannsynligheten for tidligere eksponering.
En positiv tuberkulintest følges opp med andre undersøkelser, som IGRA-test (se avsnitt 8.5) og lungerøntgen. God anamnese og klinisk undersøkelse hører også med.
I tilfeller der det foreligger mistanke om latent infeksjon eller aktiv tuberkulose, skal vurderingen om henvisning til spesialist foretas uavhengig av resultatet av tuberkulintesten. Dette gjelder for diagnostikk av tuberkulosesykdom, screening av personer i utsatte grupper som misbrukermiljøer og ved andre sykdomstilstander, for eksempel immunsvikt. Risikoen for falskt negative reaksjoner kan hos disse personene være stor og vanskeliggjøre tolkningen av resultatet. Den individuelle vurderingen bør derfor gjøres av spesialist.
8.4.5 Forhold som kan gi falskt positive tuberkulinreaksjoner
- Gjennomgått BCG-vaksinasjon
- Infeksjon med atypiske mykobakterier
- Boostereffekt (forsterkningsreaksjon) etter gjentatt tuberkulintesting
Falske positive reaksjoner er vanligst ved infeksjon med NTM. Disse infeksjonene gir oftest en svakt positiv tuberkulinreaksjon. Mistanke om smitte med NTM oppstår vanligvis ved undersøkelse før BCG-vaksinering, eller ved undersøkelser som ledd i smitteoppsporinger. Forholdsvis liten indurasjon (6–9 mm), avtagende reaksjon ved ny prøve etter seks måneder, ingen kjent eksponering for tuberkulosesmitte eller tegn til tuberkulosesykdom er forhold som vil tale for at det dreier seg om en uspesifikk reaksjon (se 11. Non-tuberkuløse mykobakterier (NTM) ).
Et individ som er tuberkulinpositiv fra tidligere, kan få en raskere og sterkere reaksjon ved gjentatt tuberkulinprøving. Denne effekten kalles ”boostereffekt”, og er mest uttalt hos eldre med svekket reaktivitet (Thompson et.al., 1979) og hvis tuberkulinprøven gjentas innen 6 uker.
8.4.6 Forhold som kan gi falskt negative tuberkulinreaksjoner (anergi)
- Alvorlig tuberkulosesykdom
- Hiv-infeksjon eller andre sykdommer som svekker immunforsvaret
- Immunsupprimerende behandling
- Enkelte virusinfeksjoner og nylig gjennomgått MMR-vaksine kan gi forbigående falskt negative reaksjoner
- Underernæring
- Høy alder
8.4.7 Sammenligning av resultater ved Pirquet- og Mantoux-test
Denne sammenligningen er vanskelig fordi Old Tuberculin som ble benyttet til Pirquet-test, og PPD inneholder litt forskjellige stoffer. Det foreligger ikke god dokumentasjon for en sammenligning i de risikogruppene som skal testes i Norge. Mantouxreaksjonene vil gjennomgående være større, særlig for de kraftige reaksjonene.
|
Adrenalin-Pirquet |
Mantoux |
|
4 mm |
6 mm |
|
7-8 mm |
10 mm |
|
8-10 mm |
16-18 mm |
8.4.8 Mantouxraksjonens størrelse
Studier av pasienter med dyrkningsbekreftet tuberkulosesykdom har vist at størrelsen på tuberkulinindurasjonen er normalfordelt med et topp-punkt rundt omkring 16-17 mm (5 TU tuberculin PPD-S). Få pasienter har reaksjoner under 10 mm, men det utgjør en viss andel (Edwards et.al., 1969) (figur 8.2 ). I Norge hadde 4,5% av menn og 7,1% av kvinner med tuberkulosesykdom i begynnelsen av 1950-tallet negativ Pirquet-prøve, 1,1% og 2,1% blant pasienter under 40-års alder, 2,0% og 4,2% i alderen 40-59 år og 13,0% og 18,4% i aldersgruppen >60 år (Statens skjermbildefotografering, 1952).
Siden det ikke finnes noen gullstandard for tuberkulosesmitte (personer med tuberkulosesmitte kan ikke bekreftes med dyrkning) er det ikke mulig å bestemme fordelingen av tuberkulinstørrelsen hos disse, men det kan antas at fordelingen er som hos pasienter med tuberkulosesykdom. I så fall vil grenseverdi på 15 mm ekskludere nesten halvparten av personer med tuberkulosesmitte, mens 10 mm som grenseverdi vil utelukke en mye mindre andel (10-15%), og en grenseverdi på 5 mm vil utelukke svært få (men fortsatt noen). En negativ test eller testresultat under 5 mm utelukker derfor verken tuberkulosesmitte eller -sykdom.
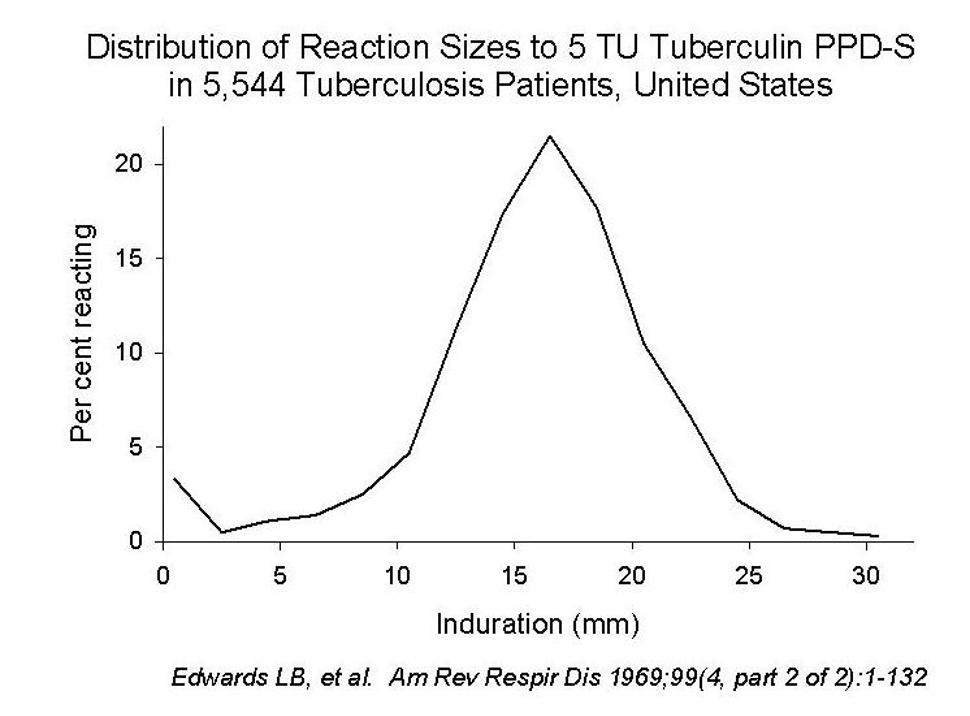
Figur 8.2 Fordeling av Mantouxreaksjon hos pasienter med dyrkningsbekreftet tuberkulose
8.4.9 Bruk av tuberkulinprøven
Smitteoppsporing rundt en tuberkulosepasient
Den viktigste anvendelse av tuberkulinprøven er å kartlegge utbredelsen av smitte rundt en pasient med lungetuberkulose. Smitte er enklest å påvise hos uvaksinerte barn, siden tuberkulintesten er enklest å tolke hos disse.
Epidemiologisk kartlegging av tuberkulosesituasjonen i en befolkning
Frem til 2009 har forekomst av tuberkulosesmitte i befolkningen vært overvåket ved tuberkulinprøving av 14-åringer før BCG-vaksinasjon. Disse undersøkelsene ga et mål for smittespredningen i befolkningen. Fra høsten 2009 utføres ikke tuberkulintesting av noen grupper i befolkningen som rutine.
Undersøkelse av personer fra land med høy forekomst av tuberkulose
Eksponering for tuberkulosebakterier er langt vanligere i land med høy forekomst av tuberkulose. De fleste barn og alle voksne fra land med høy forekomst av tuberkulose med positiv tuberkulinreaksjon må derfor antas å være smittet med tuberkulosebakterier.
Utredning av klinisk sykdom hos pasient
Tuberkulinprøven kan være til nytte ved sykdomsutredning. Den kan styrke diagnosen tuberkulose ved positiv klinikk og røntgenfunn. Prøven kan imidlertid være negativ eller bare svakt positiv ved klinisk sykdom, særlig hos eldre, ved miliær og ved utbredt sykdom og annen årsak til svekket immunrespons. Tuberkulinreaktivitet er svak fram til cirka 6 måneders alder, og den svekkes allerede fra 50 års alder. Tuberkulosediagnose må bekreftes ved positive dyrkningsprøver.
8.5 Interferon-Gamma Release Assays (IGRA)
8.5.1 Bakgrunn for testene
Interferon-gamma (IFN-γ) release assays (IGRA) har langt på vei erstattet tuberkulintesten (Mantoux) ved diagnostikk av latent tuberkulose i lav-endemiske land (ECDC, 2011, WHO, 2015). Disse immunologiske testene skal først og fremst nyttes for påvisning av latent tuberkulose fordi en betydelig andel av de med aktiv tuberkulose har falsk negativ test (Menzies, 2007). Testene er best egnet ved målrettet screening av definerte risikogrupper, i smitteoppsporinger ved utbrudd og for påvisning av latent tuberkulose hos personer med svekket immunforsvar (se kap. 5 og 6). Testene vil være til hjelp når man skal beslutte hvilke personer som bør undersøkes av spesialist og som vil være aktuelle for forebyggende behandling.
Testene er basert på laboratorieanalyse av en blodprøve og fungerer på den måten at T-celler fra blod stimuleres med peptider fra definerte antigener som er spesifikke for M. tuberculosis-komplekset (MTB); ESAT-6 og CFP-10. Hvis cellene responderer med sekresjon av IFN-γ, indikerer dette at det foreligger en tuberkuloseinfeksjon. IGRA kan således være positiv både ved latent og aktiv tuberkulose, men kan ikke differensiere mellom disse tilstandene. Antigenene som brukes i testene, forekommer ikke i vaksinestammen M. bovis BCG eller i de fleste NTM (non-tuberkuløse mykobakterier), med unntak av M. kansasii, M. szulgai og M. marinum som kan gi et falskt positivt resultat. IGRA har derfor en langt høyere spesifisitet (>95 %) enn tuberkulintesten ved at de skiller mellom smitte forårsaket av MTB-komplekset og NTM eller gjennomgått BCG-vaksinasjon. Sensitiviteten for IGRA er 70–97 % og varierer med hvilken test som benyttes og hvilken populasjon som testes (Diel, 2011) . Det er funnet lavest sensitivitet hos immunsvekkede og barn under 5 år. IGRA har likevel noe bedre sensitivitet enn tuberkulintesten hos personer med svekket immunforsvar.
Det foreligger i dag to tester som er kommersielt tilgjengelige. Testene er noe forskjellige med hensyn til praktisk utførelse, metode for måling av IFN-γ og kostnad.
QuantiFERON® TB-GOLD Plus (QFT) (QuantiFERON) måler nivået av IFN-γ i plasma med ELISA-teknikk. Testen er etablert ved regionsykehusene og enkelte andre mikrobiologiske laboratorier. En oppdatert test; QFT®-Plus tilbyr > 95% sensitivitet og høy spesifisitet.
T- SPOT-TB® (T-spot) (Oxford Immunotec) er en ELISPOT basert test som detekterer IFN-γ-produserende T-celler (spots) og påvirkes derfor mindre av celletall i blodprøven. Testen er derfor mer sensitiv enn tuberkulintest og QFT for individer med immunsvikt, inkludert personer med lavt CD4-tall. Testen har en mer omstendelig prosedyre og er per i dag et supplement til QFT-testen. T-SPOT-TB utføres kun ved Folkehelseinstituttet. Ta kontakt med aktuelle laboratorier for instruks om prøveforsendelse.
8.5.2 Når skal IGRA anvendes
-
Diagnostikk av latent tuberkulose ved smitteoppsporing og i risikogrupper
-
Utelukke falsk positiv tuberkulintest pga NTM-infeksjon, BCG-vaksinasjon eller gjentatt tuberkulintesting.
-
Utelukke falsk negativ tuberkulintest på grunn av svak immunrespons ved ulike typer immunsvikt (T-celle-anergi).
Testene kan benyttes direkte uten tuberkulintest først (se kap. 5 og kap. 6), spesielt hos populasjoner der man forventer høy andel av falsk positiv tuberkulintest. Dette kan gjelde både BCG-vaksinerte personer og helsearbeidere som har fått gjentatt tuberkulintesting (Ringshausen, 2012). Det er vist at over 50% av et utvalg av helsearbeidere i Norge som var aktuelle for screening, hadde positiv tuberkulintest, mens andelen som var IGRA-positive bare lå rundt 3% (Gran, 2013, Storla, 2009) .Ved screening av asylsøkere kan det også pga praktiske forhold være ønskelig å ta IGRA direkte (Winje, 2008).
-
QFT anbefales som første valg.
-
T-spot anbefales sekundært til inkonklusiv QFT og eventuelt ved negativ QFT, særlig hos personer med immunsvekkelse og dersom det foreligger sterk mistanke om tuberkulosesmitte med indikasjon for forebyggende behandling
-
Hos hiv-positive bør en negativ IGRA kontrolleres etter stigning i CD4-tall.
-
Personer med sterk mistanke om smitte eller svekket immunforsvar bør henvises til spesialist selv ved negativ IGRA.
8.5.3 Tolkning av IGRA-resultater
Tolkning av IGRA (QFT)-resultater gjøres ved mikrobiologisk laboratorium. Det er anbefalt at laboratoriene rapporterer både en kvalitativ og kvantitativ tolkning.
Kvalitativ tolkning:
- Positiv: Infeksjon med M. tuberculosis er sannsynlig. Testen skiller ikke mellom latent og aktiv infeksjon.
- Grenseverdi/gråsone: Resultatet er usikkert (hverken positivt eller negativt) fordi det ligger i nærheten av testens cut-off og innenfor testens variasjonsområde. Det bør tas ny prøve.
- Inkonklusiv: Resultatet lar seg ikke vurdere fordi responsen enten er for lav i positiv kontroll eller prøven har for høy bakgrunnsaktivitet. Dette kan skyldes forhold hos pasienten eller feilbehandling av prøven. Ny prøve anbefales. Ved kjent immunsvekkelse, rekvirer T-spot TB fra Folkehelseinstituttet.
- Negativ: Infeksjon med M. tuberculosis er lite sannsynlig.
Kvantitativ tolkning:
Kvantitativt resultat av QuantiFERON rapporteres som INF-γ verdi målt i IU/ml. Denne informasjonen kan særlig være nyttig for å vurdere indikasjon for forebyggende behandling ved svakt positive prøvesvar.
På gruppenivå har en norsk studie vist en sammenheng mellom målt INF-γ verdi og sannsynlighet for utvikling av tuberkulose (Winje, 2018). Studien viser at opp til en verdi på ca 4 IU/ml, er sannsynligheten for utvikling av tuberkulose større jo høyere INF-γ verdien er. I studien ble det brukt en eldre versjon av QFT (Quantiferon TB Gold) enn den som brukes i laboratoriene i Norge i dag (Quantiferon TB Gold Plus), men det antas at funnene fortsatt har gyldighet.
Alle med verdi over 1 IU/ml bør vurderes med tanke på forebyggende behandling. Ved svakt positivt resultat under 1 IU/ml bør man i større grad vektlegge pretestsannsynlighet for tuberkulose, samt pasientens immunstatus.
I grupper med svært lav sannsynlighet for tuberkulose, som hos norskfødte som ikke har kjent eksponering eller eksponering langt tilbake i tid, vil en svakt positiv test (INF-γ verdi < 1 IU/ml) ha svært lav positiv prediktiv verdi. Pasienter i denne gruppen bør re-testes. Ved ny lav positiv verdi, kan man vurdere å ikke igangsette forebyggende behandling.
I grupper med høy pretest sannsynlighet, slik som nylig smitteeksponerte og nyankomne fra land med særlig høy forekomst, bør forebyggende behandling vurderes hos alle med positiv IGRA, også for de med lave positive verdier under 1 IU/ml.
8.5.4 IGRAs begrensning
IGRA har varierende grad av sensitivitet, særlig blant små barn og personer med immunsvikt, og resultatet må alltid sees i sammenheng med smitterisiko, immunstatus og resultat av annen diagnostikk. Personer med sterk mistanke om tuberkulosesmitte og negativ test bør derfor henvises til spesialisthelsetjenesten for vurdering av behov for oppfølging og behandling. For å konkludere med negativt svar etter kjent smitteeksponering må det ha gått minst 8-10 uker.
Testene anbefales ikke brukt som mål på effekt av behandling siden det er vist at de fleste som får forebyggende behandling for latent tuberkulose fortsatt har positiv IGRA etterpå (Dyrhol-Riise, 2010).
Det er betydelig variasjon i testresultater for IGRA. Variasjonen har størst praktisk betydning for resultater rundt cut-off, noe som gjør at enkelte personer som gjentatte ganger testes noen ganger tester positivt og andre ganger negativt uten at dette trenger bety en endring i smittestatus (Aichelburg, 2014, Metcalfe, 2013). Resultater nær cut-off for testen må derfor tolkes forsiktig, og man bør vurdere å reteste eller følge pasienten før man beslutter om forbyggende behandling skal tilbys. De fleste laboratorier tar høyde for dette i sine besvarelser.