Poliovaksine (poliomyelitt) - veileder for helsepersonell
Oppdatert
Poliovaksine inngår i barnevaksinasjonsprogrammet i form av kombinasjonsvaksine.
Sykdommen
Poliomyelitt (polio) forårsakes av poliovirus av type 1, 2 eller 3 og rammer bare mennesker. Infeksjonen fører i de fleste tilfeller til virusreplikasjon i tarmkanalen uten symptomer eller med bare lette symptomer som feber, katarralia, muskelsmerter eller kvalme og oppkast [1]. Hos en liten andel (ca. 1 av 1000 i småbarnsalder og 1 av 100 i voksen alder) opptrer alvorligere sykdom med hjernehinnebetennelse og/eller lammelser.
Utbrudd av poliomyelitt ble i Norge første gang beskrevet i 1868 [2]. Tidlig på 1950-tallet var det store polioepidemier her i landet, med over 2000 tilfeller av lammelser og/eller hjernehinnebetennelse i 1951 og nesten 1000 tilfeller i 1950 og 1953. Dødeligheten var om lag 10 %. Sykdommen kom raskt under kontroll i Norge etter at vaksinen ble tilgjengelig skoleåret 1956/57, se figur 1. Det har ikke forekommet poliosmitte her i landet siden 1969, men det har vært enkelte importerte poliotilfeller. For å hindre at sykdommen introduseres igjen, er det viktig å sikre vaksineimmunitet hos så mange (over 85 %) at viruset ikke får noen mulighet til å spre seg.
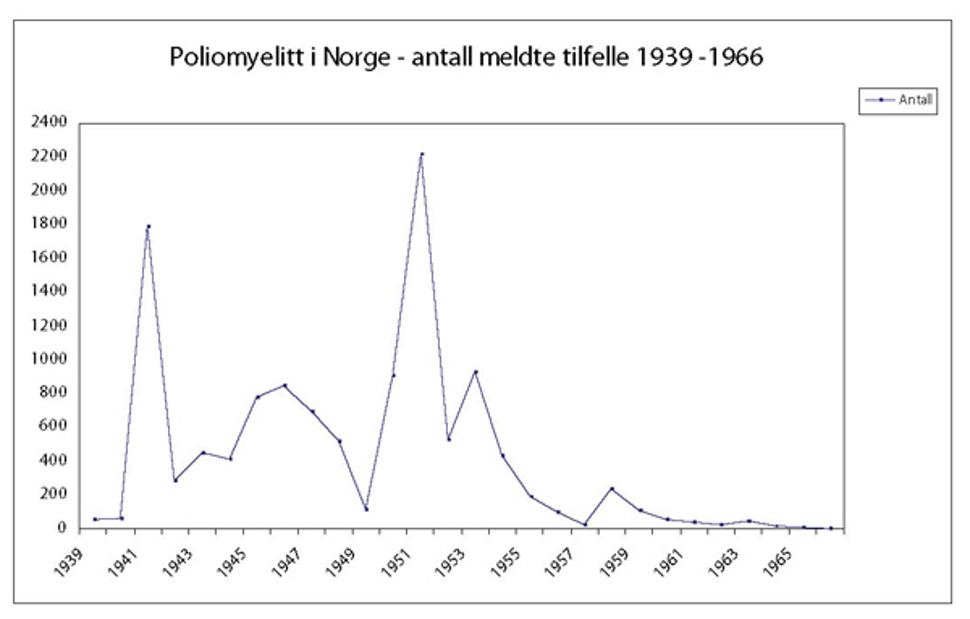
Figur 1: Antall meldte tilfeller av poliomyelitt i Norge 1939-1966. Kilde: Statistisk sentralbyrå
Sykdommen er nå i rask tilbakegang, og er utryddet fra store deler av verden. Europa ble erklært poliofritt i juni 2002 [3]. Per mars 2022 forekommer poliomyelitt endemisk i Afghanistan og Pakistan [4]. Antall land med utbrudd av importert polio og antall meldte tilfeller globalt er lavere enn noen gang før, men enkelte land og områder har bekymringsfull lav poliovaksinasjonsdekning. Covid-19 pandemien har ført til ytterligere utfordringer og forsinkelser i poliovaksinasjon og sykdomsovervåkning i flere land. Smitteførende friske personer kan komme til Norge, og uvaksinerte personer kan bli smittet under reiser og smitte andre uvaksinerte etter hjemkomst. Poliovirus finnes fremdeles i kloakk i flere land som for lengst har utryddet poliomyelitt. Så lenge det finnes polio i verden, er høy vaksinasjonsdekning og god sykdomsovervåking helt nødvendig. I områder med lav vaksinedekning kan vaksinevirus fra oral levende vaksine sirkulere og igjen bli sykdomsfremkallende og dermed forårsake poliosykdom hos uvaksinerte og ufullstendig vaksinerte personer. Utbrudd av vaksinederivert poliovirus forekommer i flere land med lav vaksinasjonsdekning.
Inaktivert poliovaksine
Inaktivert poliovaksine (IPV) ble utviklet av Jonas Salk i USA og godkjent for bruk i 1955. I Norge ble vaksinen tilgjengelig høsten 1956 og de første som fikk den var skolebarn fra skoleåret 1956/57. Fra 1958 har poliovaksine inngått i det anbefalte barnevaksinasjonsprogrammet. Levende oral vaksine ble brukt fra 1965 til 1979, deretter ble inaktivert vaksine tatt i bruk igjen.
Den trivalente inaktiverte poliovaksinen som brukes i Norge, framstilles av poliovirus type 1 Mahoney, type 2 MEF-1 og type 3 Saukett dyrket i Vero-celler. Vaksinen finnes som ren poliovaksine og som kombinasjonsvaksine (DTP-IPV-Hib, DTP-IPV og dtp-IPV). Ingen av vaksinene inneholder thiomersal.
- Inaktivert poliovaksine har ATC-kode J07BF03 og SYSVAK-kode POL03.
- DTP-IPV-Hib har ATC-kode J07CA06 og SYSVAK-kode KOM06.
- DTP-IPV-Hib-Hep B har ATC-kode J07CA09 og SYSVAK-kode KOM09.
- DTP-IPV og dtp-IPV har ATC-kode J07CA02 og SYSVAK-kode KOM02.
Fullstendig preparatomtale (SPC) finnes ved søk på vaksinens produktnavn eller ATC-kode på legemiddelsøk på Direktoratet for medisinske produkters nettsider.
Indikasjoner inaktivert poliovaksine
- Barn i henhold til det anbefalte barnevaksinasjonsprogrammet
- Reiser til områder hvor poliomyelitt kan forekomme, avhengig av tidligere vaksinasjonsstatus
- Smitterisiko under yrkesutøvelse
- Voksne flyktninger, asylsøkere og familiegjenforente som ikke er vaksinert med inaktivert poliovaksine bør tilbys vaksine fortrinnsvis innen 3 måneder og senest 1 år etter ankomst i Norge. Vaksinen kan gis i form av kombinasjonsvaksine mot difteri, stivkrampe, kikhoste og polio.
Kontraindikasjoner inaktivert poliovaksine
- Alvorlig reaksjon etter tidligere dose
- Akutt sykdom med feber over 38 °C
Gjennomgått poliomyelitt er ikke kontraindikasjon mot vaksinen. Personen er sannsynligvis ikke immun mot alle tre poliovirustyper, og skal derfor tilbys poliovaksine på samme indikasjoner som andre.
Graviditet inaktivert poliovaksine
Graviditet er ikke kontraindikasjon mot poliovaksine. Den gang poliomyelitt var vanlig i industrialiserte land, ble det klart at svangerskap var en risikofaktor for paralytisk polio, men sykdommen førte ikke til fosterskade [5]. Det er ingen holdepunkter for at fosteret skades om mor får levende eller inaktivert poliovaksine. Se også kapittel om vaksinasjon av gravide og ammende i Vaksinasjonsveilederen for helsepersonell (FHI).
Bivirkninger inaktivert poliovaksine
IPV gir svært lite bivirkninger. Det er ikke dokumentert sammenheng med noen andre uønskede hendelser enn milde lokalreaksjoner [1]. Det ser ikke ut til å bli mer bivirkninger med økende antall doser. Bivirkninger til ikke-levende vaksiner pleier å begynne i løpet av 1-2 døgn etter vaksinasjon og være kortvarige.
- Rødhet, hevelse og ømhet på injeksjonsstedet
- Urtikaria forekommer, men årsakssammenheng med IPV er usikker
Anbefalt vaksinasjonsregime inaktivert poliovaksine
- I barnevaksinasjonsprogrammet gis DTP-IPV-Hib-HepB ved alder 3, 5
og 12 måneder. Premature barn født før svangerskapsuke 32, skal tilbys en ekstra dose (dose 0) DTP-IPV-Hib-Hep B ved alder 6-8 uker. Boosterdoser gis i skolealder. Kombinasjonsvaksinen kan også brukes ved forsinket vaksinasjon, men barn over 5-6 år trenger ikke Hib-vaksine, se kapittel om Hib-vaksinasjon (Haemophilus influenzae type b) i Vaksinasjonsveilederen for helsepersonell (FHI). - Poliovaksinasjon bør alltid påbegynnes før utreise for spedbarn som skal tas med til område hvor poliomyelitt kan forekomme. Poliovaksine kan ved behov gis helt fra fødselen [6]. Doser gitt før alder 8 uker er ikke tellende i det norske barnevaksinasjonsprogrammet. Se også artikkel om poliovaksinasjon ved opphold i land med polioutbrudd (FHI).
- Til basisvaksinasjon av voksne anbefales tre doser av DTP-IPV vaksine
gitt med samme minimumsintervall som til spedbarn. Se også kapittel om vaksinasjon av tidligere uvaksinerte voksne i Vaksinasjonsveilederen for helsepersonell (FHI). Anbefalt intervall mellom 1. og 2. dose er 4 - 8 uker. Mellom 2. og 3. dose anbefales intervall på ett års tid (minimumsintervall 6 måneder i tredoseprogram), intet maksimumsintervall. Det samme gjelder dersom man velger å grunnvaksinere med monovalent poliovaksine. - Boostervaksinasjon av voksne som tidligere er grunnvaksinert er aktuelt når det er gått 10 år eller mer siden forrige vaksinedose. Et unntak er ved reise til land med pågående polioutbrudd, se artikkel om poliovaksinasjon ved opphold i land med polioutbrudd (FHI).
Varighet av beskyttelsen og behov for boosterdoser inaktivert poliovaksine
Etter to doser oppnår mer enn 90 % immunitet av minst ett års varighet mot alle tre virustyper. Hvis 3. vaksinedose settes minst seks måneder etter 2. dose, varer beskyttelsen lenge. Ca. 95 % av de barna som er vaksinert etter vanlig program, har beskyttende antistoffer ved skolestart. Etter en boosterdose ved skolestart har over 99 % av barna beskyttende antistoffer mot de tre poliovirustypene [7].
Hvis intervallet mellom 2. og 3. dose er under 6 måneder, må kortere varighet av beskyttelsen påregnes. For å ha vedvarende beskyttelse anbefales i slike tilfeller en boosterdose etter 1-4 år. Selv om intervallene overskrider det som anbefales, er alle gitte doser gyldige (ingen maksimumsintervall).
I voksen alder er det aktuelt med boosterdoser med intervall på 10-15 år. Personer som er basisvaksinert vil få beskyttelse etter en enkelt boosterdose selv om det er gått flere tiår siden forrige vaksinedose [8].
Oral poliovaksine
Trivalent oral poliovaksine (tOPV) ble utviklet av Albert Sabin og tatt i bruk i USA første gang i 1959. Vaksinen inneholdt levende svekket virus (Sabin-stammer) av type 1, 2 og 3 og var den vanligst brukte poliovaksinen frem til 2016. Monovalente vaksiner mot type 1 (mOPV1) og type 3 (mOPV3) har vært i bruk i noen land fra 2005 og bivalent OPV mot type 1 og 3 fra 2009 [1].
I Norge ble tOPV brukt i barnevaksinasjonsprogrammet fra 1965 til 1979. Den levende vaksinen kan i sjeldne tilfeller føre til poliomyelitt (vaksineassosiert paralytisk polio – VAPP) hos den vaksinerte eller hos en ikke-immun person som smittes med vaksinevirus fra den vaksinerte [1]. Det skjedde også i Norge. OPV ble lagerført ved Folkehelseinstituttet i mange år etter at den var tatt ut av barnevaksinasjonsprogrammet, men siden 2009 har den ikke vært tilgjengelig her i landet. Det er flere land som i senere tid har gått over fra levende til inaktivert poliovaksine i sine vaksinasjonsprogram [9;10].
Type 2 villvirus er utryddet, og i 2016 ble derfor all oral poliovaksine endret fra trivalent til bivalent vaksine. Studier tyder også på at bOPV gir betydelig bedre immunrespons for polio type 1 og 3 enn tOPV [11]. En monovalent vaksine mot poliovirus type 2 finnes i egne lagre hos WHO for bruk ved utbrudd med vaksinederivert poliovirus (cVDPV) type 2.
IPV og tOPV/bOPV regnes generelt som likeverdige, men i enkelte land har tOPV/bOPV gitt dårligere beskyttelse. I tillegg vil barn som kun har fått bOPV mangle beskyttelse mot cVDPV2. Barn som bare har fått OPV bør derfor få en dose IPV for å regnes som fullvaksinerte i Norge [12].
Bivirkninger oral poliovaksine
Den alvorligste bivirkningen er vaksineassosiert paralytisk poliomyelitt (VAPP). Tilstanden arter seg som paralytisk polio og oppdages bare i befolkninger hvor polio er blitt en sjelden sykdom. Globalt er forekomsten om lag 1 tilfelle per 750 000 vaksinerte barn [1].
Varighet av beskyttelsen og behov for boosterdoser oral poliovaksine
Vanligvis gir tOPV samme beskyttelse som IPV. Fra India er det imidlertid rapportert at deres OPV er mindre immunogen enn OPV i vestlige land, slik at barna trenger flere doser for å oppnå tilsvarende immunitet [12]. Det samme er tilfelle i flere andre lavinntektsland.
Bestilling og utlevering av poliovaksine
Poliovaksine i form av DTP-IPV-Hib-Hep B, DTP-IPV-Hib, DTP-IPV og dtp-IPV til barn og ungdom finansieres over statsbudsjettet. Vaksine bestilles direkte fra Folkehelseinstituttet.
Personer som har gjennomgått stamcelletransplantasjon får vaksinen på blå resept. Vaksinen rekvireres fra apotek eller Folkehelseinstituttet [13].
Lavdose kombinasjonsvaksine mot difteri, stivkrampe, kikhoste og polio (dtp-polio) leveres ut gratis til voksne asylsøkere, flyktninger og familiegjenforente. Ved bestilling må det påføres at bestillingen gjelder disse gruppene. Bestilling må gjøres av lege. Personopplysninger er ikke nødvendig.
Oversikt over tilgjengelige preparater og priser blir kontinuerlig oppdatert på nettsiden Preparater og priser (FHI).