PAH
Publisert
Eksponering for PAH i uteluft kan føre til helseskader. Folkehelseinstituttet og Miljødirektoratet har fastsatt kriterier for hvilke nivåer som er trygge for de aller fleste.
Her er de nye luftkvalitetskriteriene for nitrogendioksid (NO2), svevestøv (PM10), fint svevestøv (PM2,5), ozon, svoveldioksid (SO2) og karbonmonoksyd (CO) .
Sammendrag - fakta om polysykliske aromatiske hydrokarboner (PAH)
Forbrenning av organisk materiale fører til dannelse av tjærestoffer eller polysykliske aromatiske hydrokarboner (PAH). PAH inkluderer flere hundre forskjellige stoffer med ulike egenskaper.
PAH forekommer i forurenset luft som damp og bundet til partikler (PM, svevestøv). Benzo(a) pyren (B[a]P) finnes i forurenset luft og kan benyttes som en markør for kreftfremkallende PAH.
Flere byer i Norge har overvåket nivåene av PAH i luft siden 2008. Målingene viser B[a]P-nivåer under 1,0 ng/m3. Biltrafikk, industri og vedfyring er viktige kilder til PAH.
Helseeffekter
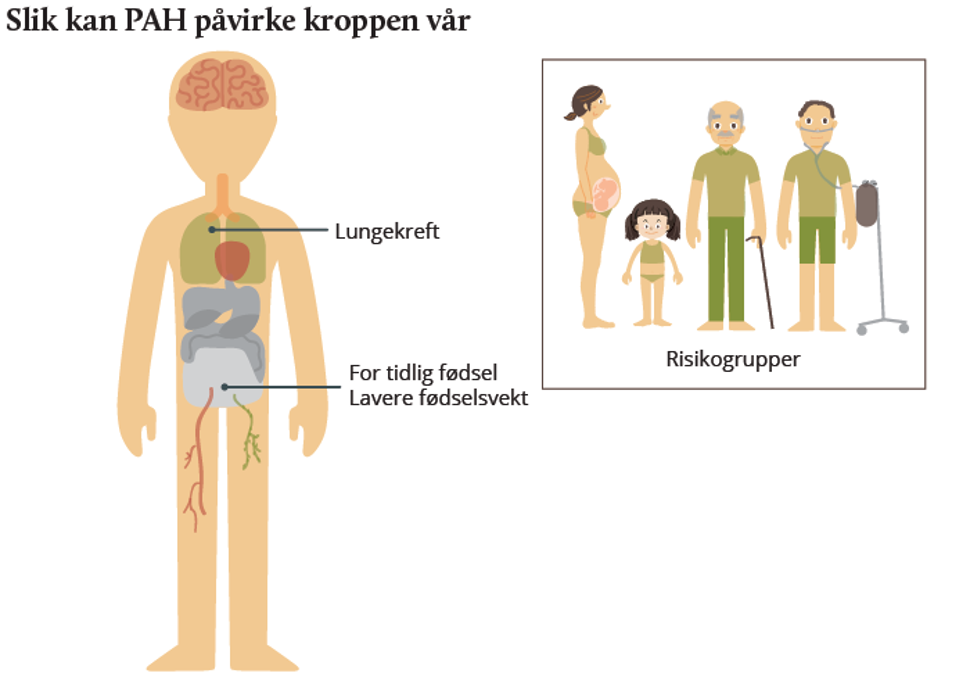
PAH-forbindelser har mange ulike egenskaper og kan derfor gi opphav til vidt forskjellige helseeffekter. Den kritiske effekten av PAH som pustes inn er kreftutvikling i lunge.
PAH bundet til partikler (svevestøv, PM) har det største kreftfremkallende potensialet, og befolkningsstudier har vist at langvarig eksponering for luftforurensning øker risikoen for utvikling av lungekreft.
Det er imidlertid vanskelig å skille ut hva som skyldes effekter av PAH og hva som skyldes partikler. Ved kreftutvikling forårsaket av PAH er genskade den viktigste årsaken, mens betennelse også synes å være involvert.
Flere studier viser sammenheng mellom PAH-nivåer og nedsatt fødselsvekt. Det er holdepunkter for at PAH-eksponering også kan forverre hjerte- og karlidelser og forårsake effekter på immunsystemet.
Utsatte/følsomme grupper: Individer med spesielle gener (f.eks. personer som i stor grad omdanner PAH til mer kreftfremkallende forbindelser) kan være mest mottagelige for å utvikle lungekreft.
I tillegg vil gravide være en utsatt gruppe. Personer som blir utsatt for sigarettrøyk, asbest og annen luftforurensning i tillegg til høye nivåer av PAH er også utsatte.
Luftkvalitetskriterium for B[a]P som et mål på PAH: 0,1 ng/m3 som årsmiddel
Kilder og luftforurensningsnivåer av PAH
Sammendrag - kilder og nivåer
Polysykliske aromatiske hydrokarboner (PAH) kalles ofte for tjærestoffer og omfatter hundrevis av ulike forbindelser. En av disse, B[a]P, blir brukt som en markør for kreftfremkallende PAH. PAH dannes ved ufullstendig forbrenning av organisk materiale. De viktigste kildene til utslipp er industrianlegg som aluminiumsfabrikker, biltrafikk, vedfyring og annen stasjonær forbrenning. Lite flyktige PAH-forbindelser finnes på svevestøv og følger svevestøvet i luftstrømmene. Langtransportert PAH kan også bidra til PAH-eksponering. Nivået av PAH i luften i de store byene i Norge er blitt markert lavere de siste 30 årene. PAH-nivåene måles i Bergen, Drammen, Oslo og Trondheim. Årsmiddelet for B[a]P i urbane miljøer varierer, men har siden 2008 vært lavere enn 1 ng/m3, som er satt som målsetningsverdi i forurensningsforskriften kapittel 7 om lokal luftkvalitet.
Egenskaper og kilder
PAH kalles ofte for tjærestoffer og finnes sjelden som rene forbindelser. PAH omfatter forbindelser som alkyl-, nitro-, amino- og halogen-substituerte PAH eller oksygenerte produkter, mens benzen ikke er inkludert. Dette dokumentet omfatter ikke halogen-substituerte PAH, som er spesielt persistente og derfor skiller seg fra andre PAH. Gruppen inneholder likevel flere hundre stoffer og deres metabolitter som igjen kan forekomme i mange ulike strukturformer (isomerer). Enkelte av forbindelsene kan være halv flyktige, mens andre har et høyt kokepunkt.
De fleste PAH-forbindelsene er meget fettløselige og lite løselige i vann. PAH i luft og vann er derfor ofte adsorbert til partikler og organisk materiale. De omsettes i kroppen og vil i liten grad opphopes i næringskjeden, men kan likevel ha lang levetid i naturen. Ulike PAH-forbindelser forekommer naturlig i råolje og er en viktig bestanddel av kreosot, tjære og asfalt. Benzo[a]pyren (B[a]P) er en PAH som er svært kreftfremkallende og brukes som markør for kreftfremkallende PAH i forurenset luft.
De største naturlige kildene for PAH-utslipp til luft er vulkanutbrudd og skogbranner. PAH er oftest uønskete biprodukter som dannes ved ufullstendig forbrenning og oppvarming av organisk materiale. Kreosotolje som ble brukt til treimpregnering inneholder PAH og var tidligere en viktig kilde til eksponering. Noen PAH-forbindelser som naftalen, acenaftalen, fenantren, fluoranten og pyren blir produsert til ulike formål.
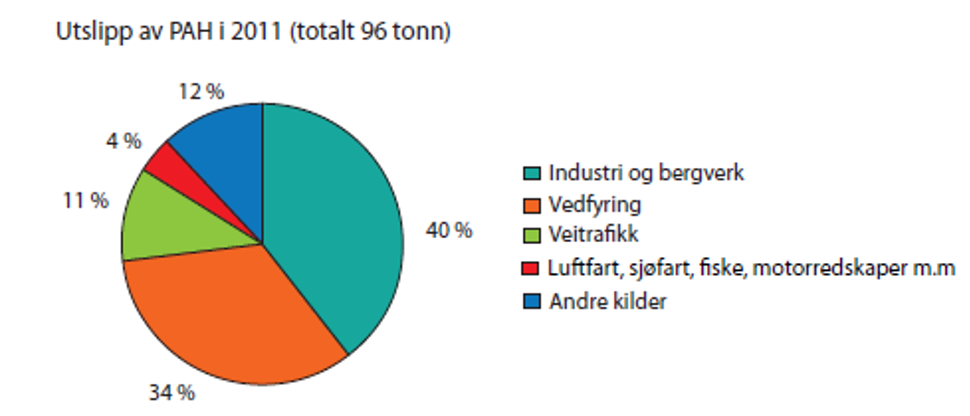
Forbrenningsprosesser som brenning av gass i Nordsjøen, biltrafikk, oljefyringsanlegg, søppelforbrenning og vedfyring gir betydelige bidrag til PAH-utslippene i Norge. På landsbasis synes utslipp fra industri og vedfyring å bety desidert mest, mens vei- og båttrafikk betyr relativt lite (se figur 1). Bidraget fra de ulike kildene varierer imidlertid mye avhengig av lokalisering og årstid. På landsbygda og i mange bystrøk vil PAH-bidraget fra vedfyring bidra mye i vinterhalvåret og særlig på kalde dager. I bystrøk med mye trafikk og lite vedfyring vil imidlertid PAH fra trafikk være viktigst, og på industristeder med spesielle utslipp kan denne kilden dominere PAH-bidraget.
Konsentrasjonen av PAH i uteluft i Norge måles i Oslo, Bergen, Trondheim, Drammen og ved enkelte industrianlegg. Industrianleggene er som oftest lokalisert i mindre byer eller tettsteder. Langtransportert PAH bidrar også til PAH-konsentrasjonen i uteluft, i 2008 ble 2060 tonn PAH tilført Norge med luftstrømmene. PAH er bundet til partikler, og kan spres via atmosfæren og med havstrømmer over store avstander. Andre kilder som kan være viktig for PAH-eksponeringen er tobakksrøyk og grillet og røyket mat.
De viktigste industrikildene for PAH er smelteverk og aluminiumsindustri. Tidligere ble store mengder PAH sluppet ut i forbindelse med gassvaskeanlegg ved de norske smelteverkene. Nedleggelse av noen av anleggene, samt prosessendringer og nye renseanlegg har gjort at slike utslipp er blitt sterkt redusert. Utslipp fra aluminiumsindustri er den største kilden i industrien, etterfulgt av ferro- og silikonmanganproduksjon og silisiumkarbidproduksjon.
Selv om utslippene har blitt redusert er vedfyring en stor kilde til PAH-utslipp. Biltrafikken er også en betydelig kilde til PAH-nivåene i trafikkbelastede byer i Norge, og konsentrasjoner av PAH i disse områdene kan være relativt høye. Mengden PAH som slippes ut i luften fra et motorkjøretøy har blitt vesentlig redusert i de senere år etter introduksjonen av nye og bedre etterforbrenningssystemer. I tillegg til forbrenning av drivstoff, vil også slitasje av bilgummi og asfalt frigjøre PAH. Slike forbindelser vil ofte være bundet til svevestøvet, blant annet til oppvirvlet veistøv.
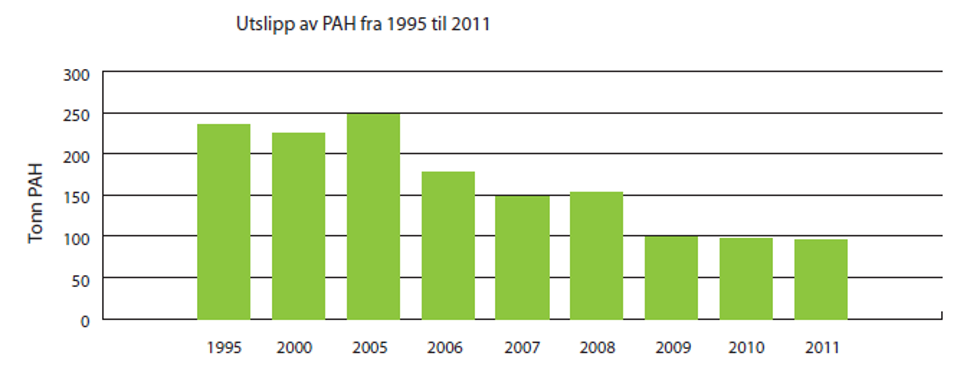
Utslippene av PAH endret seg lite fra 1995 til 2005, men etter 2005 er utslippene betydelig redusert (se figur 2).
I tillegg til å få økt kunnskap om mengden av utslippene, er det viktig å studere betydning av endringer i PAH-profilen ved ulike forbrenningsprosesser.
Spesielt ved omlegging til ny teknologi, er det viktig at utslippet av ”skadelige” PAH-forbindelser blir redusert, og ikke økt. Dette gjelder også undergrupper av PAHer som det nå er stor interesse for, slik som nitro-PAH og oksygenert PAH. I en studie [1] ble en rekke PAH, nitro-PAH og oksygenert PAH i uteluft karakterisert og diskutert opp mot mulige kilder. Forekomsten av oksygenert PAH lå i samme størrelsesområde som PAH, mens nitro-PAH var 10-100 ganger lavere. Hovedkilde for alle disse stoffene var bensin- og dieselkjøretøyer, hovedsakelig ved direkte utslipp, men også indirekte via fotokjemiske prosesser.
Eksponering og forurensningsnivåer i Norge
Det finnes lite data om nivåer av ulike PAHer i byluft i Norge. Likevel er det klart at nivået av PAH i luftforurensning i de store byene i Norge er blitt markert lavere de siste 30 årene. Nivåene av B[a]P i norske byer synes å ligge under 1 ng/m3 (figur 3). Det finnes mer data fra industrianlegg lokalisert i mindre byer eller tettsteder. Flere industristeder og byer er pålagt å overvåke PAH i luft fra 2008, og dette har gitt en bedre oversikt over B[a]P-nivåene i Norge.
![Figur 3. Årsmiddelkonsentrasjon av B[a]P i norske byer og ved regionale bakgrunnsstasjoner. Grønn linje viser luftkvalitetskriteriene. Stiplet rød linje viser målsetningsverdien i forurensningsforskriften kapittel 7 om lokal luftkvalitet. Kilde: Sentral database for luftovervåkningsdata, 2013 Figur 3. Årsmiddelkonsentrasjon av B[a]P i norske byer og ved regionale bakgrunnsstasjoner. Grønn linje viser luftkvalitetskriteriene. Stiplet rød linje viser målsetningsverdien i forurensningsforskriften kapittel 7 om lokal luftkvalitet. Kilde: Sentral database for luftovervåkningsdata, 2013](/globalassets/bilder/figurer-og-tegninger/uteluft_pah_figur-3.png?preset=mainbodywidth&maxwidth=970&width=970)
I et europeisk samarbeidsprosjekt ble det imidlertid i 2002/2003 foretatt målinger av en rekke PAH-komponenter på svevestøv (PM10) ved ulike årstider [2]. Målinger fra en trafikkert gate i Oslo ble inkludert i denne studien, disse målingene tydet på at totale PAH-nivåer kan variere fra 100 til over 800 ng/mg PM10. Det ville tilsvare en luftkonsentrasjon på 5 til 40 ng/m3 PAH ved en svevestøvkonsentrasjon på 50 μg/m3. Tilsvarende lå konsentrasjonen av B[a]P, mellom 0,2 og 1,6 ng/m3 luft. Dette er i samsvar med at årsmiddelet for B[a]P i urbane miljøer vanligvis vil være lavere enn 1 ng/m3.
Dataene viser også sesongvariasjoner med 10 ganger høyere PAH/ B[a]P-nivåer om vinteren enn om sommeren. Forskjellene kan skyldes ulike kilde bidrag, for eksempel ser det ut til at svevestøv fra vedfyring kan inneholde opptil 40 ganger mer PAH enn svevestøv fra veitrafikk [3]. Det foregår målinger av PAH-konsentrasjoner i Oslo i forbindelse med EU-prosjektet ESCAPE. Dette vil gi en bedre oversikt over PAH-konsentrasjoner i forskjellige sesonger og bedre kunnskap om enkelte undergrupper som nitro-PAH.
Det er tidligere foreslått alternative PAH markører som kan erstatte B[a]P, blant annet fluoranten og dibenzo[a,h]antrazen. Fluoranten er en viktig, flyktig PAH-komponent og forekommer i relativt store mengder i forurenset luft (2 til 10 ganger høyere konsentrasjon enn B[a]P), men stoffet er mindre kreftfremkallende i eksperimentelle systemer. Dibenzo[a,h] antrazen derimot er et svært potent PAH-karsinogen (10 til 100 ganger mer potent enn B[a]P), men forekommer i relativt lave konsentrasjoner i luft. Det vil være en stor fordel å finne en passende indeks for de kreftfremkallende effektene av PAH i forurenset luft, men dette er foreløpig ikke gjennomført pga. de mange forskjellene i egenskaper. Derfor anses fortsatt B[a]P som den beste markøren for PAH [4].
Inntak av PAH via mat er en langt viktigere eksponeringsvei enn luft. PAH i mat kan dannes under tilberedning eller ved nedfall av PAH fra luft på avlinger [4].
Det relative bidraget av luftbåren PAH til mat er ikke helt klarlagt. Drikkevann ser ut til å være en mindre eksponeringsvei på grunn av den lave vannløseligheten av PAH. Beregninger på totalt inntak av PAH hos en ikke-røyker (mann mellom 19 og 50 år i USA) ligger på 3,12 μg/dag, hvorav mat bidro med 96 % og luft med omtrent 2 %. Røykere som røykte en pakke med sigaretter uten filter hadde i tillegg et inntak på 15 µg/dag.
Helseeffekter av PAH
Sammendrag - helseeffekter
De ulike PAH-forbindelsene har helt ulike egenskaper og kan derfor tenkes å bidra til vidt forskjellige helseeffekter. Eksempler er kreft, hjerte- og karlidelser, fosterskader og skader på arvematerialet. Innåndet PAH er hovedsakelig bundet til sotpartikler. Avsetningen av PAH bestemmes dermed av partiklene i luftveiene. Den kritiske effekten av PAH er kreftutvikling. Ved innånding er lungekreft den viktigste effekten. Dannelse av reaktive PAH-metabolitter synes å være en sentral mekanisme for helseeffekter, spesielt kreftutvikling. Slike reaktive metabolitter kan binde seg til arvematerialet (DNA). Dette kan føre til DNA-skade og gi mutasjoner.
Studier i arbeidsmiljø og dyreeksperimentelle studier har gitt kunnskap om risikoen for kreftutvikling ved langvarig eksponering for høyere PAH-nivåer enn det som forekommer i uteluft. Befolkningsstudier har vist at forurenset uteluft gir en økt risiko for lungekreft. Det er vanskelig å skille ut hva som skyldes effekter av PAH i disse studiene, hva som skyldes partikler i seg selv eller andre komponenter på partiklene. Personer som er eksponert for høye PAH-nivåer sammen med andre forbindelser som sigarettrøyk, asbest og miljøgifter, kan være spesielt utsatt for helseeffekter. Personer med sykdom relatert til lunge- og hjerte-karsystemet, foster og unge mennesker, og genetisk predisponerte grupper vil være følsomme for effekter av PAH.
Inhalasjon og avsetning/omsetning
PAH kan tas opp i kroppen både gjennom lungene, magetarmkanalen og huden [5]. Imidlertid synes kreftrisikoen ved PAH-eksponering å være større ved innånding enn opptak via mat. Innåndet PAH er hovedsakelig adsorbert til sotpartikler. Avsetningen av PAH i luftveissystemet vil dermed avhenge av partikkelstørrelsen (se Svevestøv). Ved innånding vil PAH-konsentrasjonene være høyest i lungevevet. PAH-forbindelsene vil også kunne nå andre organer, men i lavere konsentrasjoner.
Ulike organer, spesielt lunge og lever, har enzymer som er i stand til å omdanne PAH-forbindelser til vannløselige metabolitter som lett skilles ut fra kroppen i urin og avføring. Til tross for den høye fettløsligheten blir derfor PAH generelt raskt omsatt og viser liten tendens til opphopning i fettvev hos mennesker. I denne omdannelsen vil det kunne dannes forskjellige reaktive stoffer (metabolitter). De ulike reaktive metabolittene har så kort halveringstid at de hovedsakelig skader cellene de dannes i.
Mekanistiske betraktninger
Mye av kunnskapen og vurderingen av kreftrisiko forbundet med eksponering for PAH er basert på dyrestudier og studier i cellekulturer [5]. Mange studier er gjort med B[a]P. Andre PAHer, deriblant nitro-PAH og heterosykliske PAH, har vært mindre studert, men har også vist seg å forårsake DNA-skade. Reaktive PAH metabolitter (epoksider samt frie radikaler) kan binde seg til arvematerialet (DNA) og danne såkalte DNA-addukter (et reaksjonsprodukt mellom PAH og DNA). Denne bindingen kan føre til at DNA blir skadet og det oppstår mutasjoner. PAH kan også føre til andre type DNA-skader (oksidative DNA-skader) ved at reaktive oksygenforbindelser (ROS) dannes. Mutasjoner i kritiske gener kan fremme kreftutvikling.
I tillegg til DNA-skade kan imidlertid PAH gi andre endringer som gir økt overlevelse (økt celledeling, redusert celledød) av skadete celler. Dersom cellen med DNA-skade reparerer skadene eller dør i det videre forløpet vil skaden ikke føre til kreft. For kreftutvikling er den relative betydningen av PAH-induserte DNA-skader versus effekter på celledød og betennelse ennå uavklart. Et viktig eksempel på hvordan PAH-metabolitter kan føre til kreftutvikling illustreres av studier med B[a]P. Det kan dannes flere strukturelt forskjellige former (isomerer) av B[a]Pdiolepoksid. De forskjellige strukturformene av B[a]Pdiolepoksid synes å ha ulikt kreftfremkallende potensial.
Binding av PAH til spesielle, cellulære reseptorer (Ahreseptor) ser ut til å være viktig for utviklingen av kreft [5]. Denne reseptoren kontrollerer mange gener involvert i metabolisme av kroppsfremmede stoffer til reaktive metabolitter og betennelsesreaksjoner. I tillegg er det foreslått at PAH kan hemme kommunikasjon mellom celler, en egenskap som har vært nært knyttet opp til svulstutvikling. Binding til Ah-reseptor til feil tid, sted eller på feil måte kan se ut til å føre til uønskede biologiske effekter. Det er foreslått at binding til Ah-reseptor vil kunne være en bedre indikator for kreft enn mutagent potensial. Dette vil imidlertid antageligvis ikke gjelde alle PAH-forbindelsene.
PAH-forbindelser med et økende antall (aromatiske) ringer (ofte mer enn 4), og gjerne med spesielle strukturer (”fjord” og ”bay region”) ser ut til å være mer aktive som mutagener og karsinogener [5]. Tilstedeværelsen av andre ringstrukturer, som for eksempel en fem-karbonsring, i molekylet kan også øke de kreftfremkallende egenskapene. Videre vil mange typer endringer av molekylet som metylering, tilstedeværelsen av en nitro- eller aminogrupper øke eller senke den biologiske potensen av PAH-forbindelsen. De toksiske egenskapene av PAH-forbindelser er på langt nær klarlagt og varierer mye. Variasjonene kan til og med være store mellom ulike isomere former av samme molekyl.
Biomarkører
Eksponering av dyr for høye doser av PAH fører til dannelse av DNA-addukter i de fleste vev, men det er ingen enkel sammenheng mellom adduktnivået i ulike vev og kreftutvikling. Ulike metoder for måling (biomonitorering) av PAH-eksponering er blitt vurdert. Disse settes opp mot hverandre og opp mot målinger/beregninger av PAH foretatt i luften. Slike metoder inkluderer analyse av ulike metabolitter i urin, og ulike metoder for å måle biokjemiske og biologiske effekter som DNA-addukter og proteinaddukter i ulike vev. Det kan imidlertid være vanskelig å koble målinger i luft med nivået av PAH-addukter i blod og ulike vev, siden andre eksponeringsveier enn innånding bidrar mye til totaleksponeringen av PAH. Målinger av ulike biomarkører har vist langt lavere nivåer i uteluft enn det som kan forekomme i yrkessammenheng. Et eksempel på dette er at nivået av 1-hydroxypyren, en metabolitt som kan måles i urin, var 100 µmol/mol kreatin hos yrkesmessig eksponerte arbeidere sammenlignet med mindre enn 0,1 µmol/mol kreatin hos andre [6].
Dyrestudier og celleforsøk
Mange PAH-forbindelser er vist å kunne gi kreft i dyreforsøk. Nyfødte mus ser ut til å være spesielt følsomme. Inhalasjon av PAH fører ofte til svulster i lungene, mens PAH i maten kan føre til svulster i magesekken, lever, lunge og brystkjertler hos forsøksdyr [5]. Når fraksjoner av kondensat fra bensinmotorer ble testet for evne til å gi lungekreft, var PAH med 47 ringer mest potente [7]. I rotter er risikoen for lungekreft etter inhalasjon av 1 ng/m3B[a]P (i en kompleks blanding av kulltjærekondenserte aerosoler) beregnet til 2x105[8].
Selv om det mest kritiske endepunktet for inhalert PAH vurderes å være lungekreft, har dyreeksperimentelle studier også vist at eksponering for PAH-forbindelser kan føre til andre helseskader som hjerte- og karlidelser, nedsatt immunforsvar, fosterskader, og genetiske skader [4]. Nivået av PAH er avgjørende for hvilke skader som kan utløses. Med hensyn til hjerte- og karlidelser synes PAH-forbindelser å kunne bidra til utvikling av arteriosklerose. Andre studier viser at PAH-forbindelsers evne til å svekke immunsystemet i mus synes å være korrelert til stoffenes evne til å gi kreft [9]. Med hensyn til fosterskader synes testikler og ovarier å være spesielt følsomme for DNA-skadende forbindelser, ettersom de inneholder raskt delende celler. PAH-forbindelsenes egenskaper som ”hormonhermere” kan imidlertid også tenkes å ha betydning for effekter i disse organene. Gentoksiske effekter av PAH er mye studert i bakterier og cellekulturer.
Det finnes få studier med rene PAH-forbindelser. Derimot finnes det mange studier av komplekse blandinger som sigarettrøyk og dieseleksos hvor PAH inngår som viktige komponenter [4]. Sigarettrøyk er kjent å gi høy risiko for lungekreft, og dette har til dels blitt tilskrevet innholdet av PAHer. Sigarettrøyk inneholder imidlertid også mange andre viktige forbindelser, som nitrosaminer, som kan være vel så viktige.
Trolig er det blandingen av mange ulike komponenter som bidrar til kreftutviklingen. Slike betraktninger er imidlertid meget kompliserte og innebærer en vurdering av betydningen av andre PAH som nitro, oksygenert PAH og cyklopenta-PAH-forbindelser, og også i kombinasjon med andre forbindelser som metaller. Dieseleksos er også vist å gi lungekreft. Denne effekten tilskrives ofte innholdet av PAH-komponenter. Imidlertid kan det ikke utelukkes at kreftutviklingen skyldes en såkalt ”particle overload”, som er en overbelastning av immunforsvaret ved svært høye konsentrasjoner av partikler.
Foruten effekter på kreftutvikling, kan dieseleksos også fremme utvikling av allergi ved å ha en forsterkende effekt på en allerede eksisterende allergenrespons. Imidlertid er det heller ikke i disse studier skilt mellom partikler, PAH eller andre stoffer [10]. Studier med ekstrakter fra dieseleksospartikler kan tyde på en rolle for PAH i betennelsesreaksjoner så vel som allergiforsterkende responser. Det kan imidlertid ikke utelukkes at andre organiske stoffer enn PAH er involvert.
Studier med partikler fra ulike byer og ulike kilder med forskjellige PAH-innhold har ikke kunnet vise en klar sammenheng mellom helseeffekter og PAH-nivåene. Dette kan skyldes ulik sammensetning av PAH. En samlet analyse av effektene av partikler fra ulike byer tydet imidlertid på at det var en sammenheng mellom allergisk respons og innholdet av total PAH og andre organiske forbindelser. Sammenhengen med en generell betennelsesreaksjon var relativt svakere [11].
Kontrollerte studier på mennesker
Undersøkelser i yrkessammenheng og i kammerforsøk viser at dieseleksos ved innånding har en akutt irriterende effekt hos menneske. Slike studier på mennesker har også vist at dieseleksos kan føre til betennelsesreaksjoner i lungene, samt effekter på blod og blodårer [12, 13, 14, 15]. Det er ikke publisert studier som er utført slik at en kan skille mellom virkningene av partiklene, komponenter på partiklene og gassene. Derfor er bidraget fra PAH til disse effektene usikkert.
Befolkningsstudier
Det er foretatt befolkningsstudier på ulike typer eksponeringer som inneholder PAH og utvikling av kreft, samt tilhørende biomarkører. Det kreftfremkallende potensialet av PAH ble tidlig klarlagt ved en økt risiko for hudkreft hos pipefeiere og personer som jobbet med tjære. Senere har befolkningsstudier vist at arbeidere i koksovn og kullgassindustri og ansatte i aluminiumsindustrien har forhøyet risiko for lungekreft. I alle disse studiene kan også andre kjemikalier i arbeidsmiljøet ha bidratt [4].
I en nylig publisert metaanalyse av sammenhengen mellom yrkeseksponering for PAH og lungekreft i 39 kohorter ble det funnet en gjennomsnittlig økt risiko på 20 % per 100 µg/m3 årsmiddeleksponering for B[a]P [16]. I denne metaanalysen er det bare inkludert studier hvor det er stor sannsynlighet for at PAHer er den utløsende årsaken til helseeffekter. Risikoen er omtrent i samme størrelsesorden som WHO kom frem til (se nedenfor). I en artikkel, som oppsummerer en rekke studier av arbeidere som er eksponert for PAH i ulike typer kull og metallindustrier, er det rapportert økt risiko for kreft i lunge og luftveier i de aller fleste av disse industriene [17].
I aluminiumsindustrien er det imidlertid ikke vist noen assosiasjon med lungekreft, men bare med blærekreft. Dette inkluderer også ulike studier fra Norge. Nivået av PAH og B[a]P i studier av yrkeseksponerte er meget høyt sammenlignet med nivået i omgivelsesluft, hvor en ikke har klare studier av PAH som sådan. For den generelle befolkning kan undersøkelsene på effekter av luftforurensning på lungekreft tyde på at PAH kan være involvert, men disse studiene er ikke tatt med i vurderingene og estimering av økt risiko. Korrelasjonen mellom eksponering for PAH-blandinger og en økt forekomst av kreft i luftveiene er spesielt mye studert for sigarettrøykere. Den økte forekomsten av denne type lungekreft er imidlertid i de senere år blitt mer knyttet til andre komponenter i tobakksrøyk, som nitrosaminer, enn til PAHer [18]. I en studie ble det funnet økt risiko for hjernekreft hos barn eksponert for PAH. Både yrkes og røykeksponering av fedre for PAH før befruktning ble assosiert med forekomst av slik kreft hos avkommet [19].
Det finnes også noen få studier hvor sammenhengen mellom PAH-eksponering og andre helseutfall enn kreft er belyst, som effekter på hjerte- og karsykdommer og på fosterutviklingen. Eksponering for PAHer i arbeidsmiljøet synes å forårsake økt dødelighet som skyldes hjerte- og karsykdommer. I disse studiene var PAH-eksponeringen høy, med gjennomsnittlig B[a]P over 273 ng/m3, som ga en økt risiko på 64 % [20]. Disse studiene inkluderer også asfaltarbeidere fra Norge.
Eksponering for PAHer under svangerskapet er blitt rapportert å gi en økt risiko for redusert fødselsvekt og for tidlig fødsel [21]. Det finnes også befolknings studier som indikerer en sammenheng mellom PAH-eksponering, fosterskade og effekter på psykomotorisk utvikling hos barn [22].
Det er gjort mange befolkningsstudier hvor det er funnet sammenheng mellom sykdom eller dødelighet og forurensning i uteluft. I flere av disse studiene er det funnet sammenheng med lungekreft, som i en amerikansk undersøkelse hvor det konkluderes med at folk som lever i de mest forurensede byområdene har en 12 % større risiko for å dø av lungekreft enn folk fra de minst forurensede områdene [23]. Det er imidlertid svært usikkert i hvilken grad den kreftfremkallende effekten skyldes ulike PAH-forbindelser, metaller eller partikkelen som sådan. Mange studier med mennesker utsatt for luftforurensning i byer og tettsteder har vist et økt nivå av DNA-addukter i blodceller som mål på biologiske effekter av PAH-eksponering, noe som kan reflektere økt kreftrisiko [5]. Siden lufteksponering ikke nødvendigvis er den viktigste kilden til PAH-eksponering, er det ingen enkel sammenheng mellom PAH og DNA-addukter i blodceller og kreftutvikling i lunge.
Forskjeller i følsomhet
Mest utsatt er personer eksponert for høye PAH-nivåer sammen med andre forbindelser som sigarettrøyk, asbest og annen luftforurensning. Videre vil personer med sykdom relatert til lunge- og hjerte- og karsystemet, foster og unge mennesker, og genetisk predisponerte grupper være mer følsomme for effekter av PAH.
Genetisk variasjon (polymorfisme) av enzymer som deltar i aktivering/avgiftning av PAH hos mennesker er velkjent, og dette kan bidra til stor variasjon i følsomhet hos ulike individer. I tillegg kan eksponering for andre stoffer som påvirker aktiviteten av disse enzymene, og dermed omdannelsen av PAH, også påvirke følsomheten hos personer [5].
Vurderinger og luftkvalitetskriterier for PAH
Vurderinger foretatt av WHO
WHO har ikke anbefalt noen spesifikke retningslinjer for PAH-konsentrasjoner i luft [4]. Mangel på kunnskap om doserespons for enkelt PAHer i komplekse blandinger, samt mangel på terskelnivå for effekt, angis som årsak til at det er vanskelig å angi en spesifikk verdi. Derimot har WHO foretatt risikoberegninger og potensvurderinger etter inhalasjon. Best data er det på B[a]P.
Estimatene for kreftrisiko baserer seg på befolkningsundersøkelser etter en yrkeseksponering for PAH. Fra slike studier har WHO beregnet at ved en livslang eksponering for 1 ng/m3 B[a]P vil risikoen for kreft i luftveiene være 8,7 tilfeller per 100 000 eksponerte. Dette tilsvarer at en B[a]P-konsentrasjon på 1,2, 0,12 og 0,012 ng/m3 luft vil gi en livstidsrisiko på 1 tilfelle per henholdsvis 10 000, 100 000 og en million eksponerte.
Luftkvalitetskriterier
Luftkvalitetskriterium for årsmiddel av B[a]P er 0,1 ng/m3. Dersom dette nivået overholdes vil risikoen for helseeffekter av PAH være minimal, og beskytte de aller fleste mot utvikling av kreft.
Økt forekomst av lungekreft synes å være den kritiske helseeffekten av PAH. I risikofastsettelse for PAH benyttes B[a]P som en indikator for kreftfremkallende effekter. Det er en usikkerhet forbundet med dose-responssammenhenger for PAH, siden PAH består av mange ulike forbindelser med forskjellig kreftfremkallende potensial. Det er også svært vanskelig å skille effekten av PAH fra andre komponenter i luften som partikler. Videre er det stor usikkerhet i ekstrapoleringer av dose-responssammenhengen fra høy dose til lav dose for kreftfremkallende forbindelser. Det er imidlertid mest akseptert å bruke en lineær sammenheng for DNA-skadende karsinogener som PAH, uten noen nedre grense/terskel for helseeffekt.
Ut fra dette er det fastsatt et luftkvalitetskriterium for årsmiddel av B[a]P på 0,1 ng/m3. Dette er et nivå som tilsier en livstidsrisiko for lungekreft på litt under 1 tilfelle i en befolkning på 100 000. Det ansees for å være en minimal risiko. I denne type risikovurderinger brukes ofte 1 på 1 million som en neglisjerbar risiko. For B[a]P vil dette tilsvare en konsentrasjon på 0,012 ng/m3, men denne konsentrasjonen vil være under bakgrunnsnivå og derfor uegnet som luftkvalitetskriterium.
På dette grunnlag er det fastsatt følgende luftkvalitetskriterium for B[a]P, som mål på PAH:
- 0,1 ng/m3 B[a]P som årsmiddel