Svevestøv
Publisert
Eksponering for svevestøv i uteluft kan føre til helseskader. Folkehelseinstituttet og Miljødirektoratet har fastsatt kriterier for hvilke nivåer som er trygge for de aller fleste.
Her er de nye luftkvalitetskriteriene for nitrogendioksid (NO2), svevestøv (PM10), fint svevestøv (PM2,5), ozon, svoveldioksid (SO2) og karbonmonoksyd (CO) .

Sammendrag - fakta om svevestøv
Svevestøv (partikler, PM) består av små, luftbårne partikler som kan stamme fra forbrenningsprosesser, eller mekanisk slitasje. Eksponering for svevestøv i uteluft kan føre til helseskader. Svevestøv varierer i størrelse og sammensetning. De viktigste størrelsesgruppene angitt i mikrometer (μM) er:
- PM0,1 (ultrafin fraksjon)
- PM2,5 (finfraksjonen)
- PM10-2,5 (grovfraksjonen)
- PM10 (grovfraksjon + finfraksjon)
Forbrenningspartikler dominerer i fin-/ ultrafin fraksjon, mens mekanisk genererte partikler som oftest dominerer i grovfraksjonen. Disse fraksjonene består av en blanding av mange ulike forbindelser, både organiske og uorganiske.
De viktigste kildene til partikler (PM10 og PM2,5) er veitrafikk, vedfyring og langtransportert forurensning. Veitrafikk bidrar mest til svevestøvnivåene mange steder, både med veistøv fra dekk- og asfaltslitasje og utslipp av eksos.
I flere norske byer og tettsteder bidrar vedfyring mye. Langtransportert svevestøv spiller også en viktig rolle for totalnivået. Noen steder er industri, forbrenningsanlegg, bygg- og anleggsaktivitet og havner viktige kilder.
I Norge måles PM10 og PM2,5. Flere norske byer og tettsteder har utfordringer med nivåene av svevestøv.
Helseeffekter
Eksponering for svevestøv er en av de viktigste miljøårsakene til for tidlig død. En rekke befolkningsundersøkelser fra hele verden viser at både korttids- og langtidseksponering for svevestøv er assosiert med sykelighet og dødelighet av hjertekar- og luftveislidelser. Risikoen for dødelighet og sykelighet er høyere ved langvarig eksponering sammenliknet med kortvarig eksponering.
Eksponering for svevestøv kan føre til:
- Forverring av symptomene til mennesker med luftveis- og hjerte- og karsykdommer
- Utvikling av luftveis- og hjerte- og karsykdommer (bl.a. ved å utløse betennelsesreaksjoner)
- Forsterking av allergi
- Effekter på: nervesystemet, fosterutvikling, sædkvalitet, stoffskiftet (f.eks. diabetes og fedme)
Svevestøv består av partikler som varierer i størrelse og sammensetning. Både størrelsen og de kjemiske egenskapene til partiklene bestemmer hvor helseskadelig svevestøvet er.
Kortidseksponering: Eksponering for dieseleksospartikler fra minutter til timer har vist seg å gi effekter på luftveier og hjerte- og karsystemet ned mot 300 μg/m3, samt å forsterke allergiske responser. Eksponering for røyk fra vedfyring i nivåer på 240-280 μg/m3 er vist å gi økte betennelsesreaksjoner i luftveiene. Metallrike partikler fra industriutslipp synes mer helseskadelig enn partikler fra andre kilder.
Byluftpartikler (150-300 μg/m3) er vist å gi betennelsesreaksjoner i luftveiene og effekter på hjerte- og karsystemet. Hos astmatikere er PM10- og PM2,5-eksponering forbundet med økt hyppighet av luftveissymptomer, økt bruk av medisiner og endringer i lungefunksjon. Studiene er utført i områder med konsentrasjoner ned mot henholdsvis 20 μg/m3 for PM10 og 6-8 μg/m3 for PM2,5.
Langvarig eksponering: Langvarig økte nivåer av PM2,5 og PM10 øker risikoen for dødelighet og sykelighet. Denne sammenhengen er funnet ned mot svært lave konsentrasjoner av PM, og er best dokumentert for PM2,5. Langvarig eksponering for PM10 og PM2,5 synes også å ha sammenheng med forekomst av luftveissymptomer, svekket lungefunksjon og hjerte- og karsykdommer. Disse sammenhengene er observert ved årsgjennomsnitt 18-68 μg/m3 for PM10 og ned mot 5 til 10 μg/m3 for PM2,5.
Andre størrelsesfraksjoner: I tillegg til PM10 og PM2,5, er PM10-2,5 (eller grovfraksjonen), PM0,1 (ultrafine partikler) og svarte karbonpartikler studert i enkelte befolkningsstudier. Grovfraksjonen synes å ha sammenheng med dødelighet og sykelighet etter kortvarig eksponering. Datagrunnlaget for ultrafine partikler og dødelighet og sykelighet er altfor tynt til å si noe om en årsakssammenheng, men enkelte studier finner assosiasjoner.
For svarte karbonpartikler er det vist sammenheng mellom både kort- og langtidseksponering og dødelighet, samt sykehusinnleggelser for astma og hjerte- og karsykdommer. Den beregnede risikoen for svarte karbonpartikler på dødelighet og sykelighet er høyere enn for PM2,5 og PM10 både ved kortvarig og langvarig eksponering.
Utsatte/følsomme grupper: Personer med luftveissykdommer, som astma, kronisk obstruktiv lungesykdom (KOLS), og hjerte- og karsykdommer er mest følsomme for svevestøv. Barn og gravide regnes også som følsomme grupper.
Luftkvalitetskriterier for svevestøv:
PM10:
- 30 µg/m3 i døgnmiddel
- 20 µg/m3 i årsmiddel
PM2,5:
- 15 µg/m3 i døgnmiddel
- 8 µg/m3 i årsmiddel
Partikkelegenskaper og viktige definisjoner av svevestøv
Svevestøv består av små, luftbårne partikler som kan stamme fra forbrenningsprosesser, eller mekanisk slitasje. Svevestøv kan være både antropogent (menneskeskapt) og naturlig forekommende. Sistnevnte kan stamme fra jorderosjon, skog og gressbranner, levende vegetasjon, sjøsprøyt (saltpartikler), sandstormer og vulkanutbrudd. Antropogent svevestøv stammer hovedsakelig fra veitrafikk, fyring og industri. Dette er de dominerende kildene i større byer. Ifølge WHO er eksponering for forurenset byluft blant verdens 20 viktigste årsaker til helseproblemer, og svevestøv ansees som den viktigste årsaken til helseskadelige effekter av forurenset luft [1, 2]. En gjennomgang av en rekke risikofaktorer for sykdom viste at luftforurensning (målt som PM2,5) var i 2010 blant de 10 viktigste globale årsaksfaktorene til sykdom/død, målt som funksjonsdyktige leveår [3]. Svevestøv (partikler, PM) varierer både i størrelse og sammensetning, og deles gjerne inn i ulike størrelsesfraksjoner.
De viktigste størrelsesgruppene er: PM10, PM2,5 og PM0,1, som hovedsakelig er partikler (mer enn 50 %) med aerodynamisk diameter under henholdsvis 10, 2,5 og 0,1 µm.
Partikler med diameter mellom 10 og 2,5 µm betegnes som grovfraksjonen, partikler med diameter under 2,5 µm som finfraksjonen, og partikler med diameter under 0,1 µm som ultrafine eller nanopartikler.
Forbrenningspartikler dominerer i finfraksjonen og i den ultrafine fraksjonen. Mekanisk genererte partikler dominerer som oftest i grovfraksjonen. Disse fraksjonene består av en kompleks blanding av en rekke forskjellige forbindelser.
Fine forbrenningspartikler består i stor grad av en karbonkjerne med kondenserte hydrokarboner (som polysykliske aromatiske hydrokarboner, PAH) og spor av metallisk aske.
Grovfraksjonen er gjerne rik på mineraler og kan inneholde mye metaller, samt noe biologisk materiale som pollen og rester fra mikroorganismer.
Svarte karbonpartikler er en ofte brukt betegnelse på forbrenningspartikler, og omfatter flere forskjellige metoder å måle slike partikler på. Derfor inkluderer svarte karbonpartikler målinger av svart røyk (BS), svart karbon (BC) og absorbans (Abs), foruten elementært karbon (EC).
Svevestøv, ofte omtalt som partikulært materiale (PM), er luftbårne partikler, og omfatter flere ulike typer av forurensingsforbindelser som igjen inneholder flere ulike kjemiske stoffer. Svevestøv varierer i størrelse fra under 10 nanometer (nm) til opp mot 100 mikrometer (µm). De ulike størrelsesfraksjonene varierer med hensyn til dannelsesmekanismer og kilder, kjemisk sammensetning og fysiske egenskaper.
Partikkelstørrelse
Fysiske egenskaper som størrelse og form er av betydning for partiklenes evne til å forårsake helseskade. Størrelse påvirker både hvor dypt partiklene kan inhaleres i luftveiene, i hvilke regioner i lungene partiklene deponeres, og hvor effektivt de avsettes (les om avsetning i luftveiene under Helseeffekter av svevestøv). Partikkelstørrelse defineres som oftest ut i fra den aerodynamiske diameter som angir størrelsen av en gitt partikkel ved å sammenligne partikkelen med en tilsvarende rund partikkel, basert på lik tetthet og luftmotstand.
Med hensyn til måling og overvåkning av svevestøv grupperes partiklene etter ulike størrelser. De viktigste størrelsesgruppene er: PM10, PM5, PM10-2,5, PM2,5, PM1 og PM0,1. Disse ulike størrelsesfraksjonene inneholder hver mer enn 50 % partikler med aerodynamisk diameter under henholdsvis 10, 5, 2,5, 1 eller 0,1 µm. PM10 kan trenge ned i luftveiene og utgjør dermed en helserisiko [4]. PM2,5 kalles for finfraksjonen, PM0,1 for den ultrafine fraksjonen (består av nanopartikler). I tillegg til størrelses gruppene nevnt over, er grovfraksjonen bestående av partikler med aerodynamisk diameter mellom 10 og 2,5 µm (PM10-2,5) også av interesse. Nær trafikkerte veier eller byggeplasser vil grovfraksjonen kunne utgjøre en relativt stor andel av massen (vekten) av svevestøvet. Partiklene i finfraksjonen vil imidlertid normalt dominere i antall og total partikkeloverflate, som er svært viktige parametere for partiklenes skadelige effekter. Antallet ultrafine partikler kan være opptil 60 000 ganger høyere enn antallet grove partikler ved lik masse [5].
Partikkelstørrelse er av betydning for partiklenes spredningsevne. Grove partikler (PM10-2,5) vil normalt holde seg svevende i minutter og opptil noen timer og partiklene vil falle ned innenfor noen titalls kilometer fra kilden. Til sammenligning vil fine partikler (PM2,5) kunne holde seg svevende i luften i dager og opptil uker og vil dermed ha mye større spredningsevne, fra noen hundre til flere tusen kilometer avhengig av meteorologiske forhold. Dette gjør at PM2,5 har en mye jevnere fordeling i byene enn grovfraksjonen, som finnes mer lokalt i nærheten av trafikkerte veier og andre kilder. Langtransportert svevestøv består hovedsakelig av fine partikler.
Partiklenes størrelse påvirker også forholdet mellom partiklenes masse og partiklenes overflateareal. Partikkeloverflaten ansees som sentral for partiklenes skadelige effekter. Desto større overflate en partikkel har, desto mer av partikkelen vil kunne komme i direkte kontakt med cellene i luftveiene og føre til helseskade. Økt overflate øker også muligheten for adsorpsjon (binding) av stoffer som metaller og PAH’er (se Partikkelsammensetning nedenfor). Disse stoffene kan bidra til partiklenes helseskadelige effekter. Ettersom små partikler har en relativt stor overflate i forhold til større partikler med lik vektmengde/masse, ansees små partikler generelt å være mest helseskadelige. Forskjeller i kjemisk sammensetning mellom store og små partikler kan imidlertid være av større betydning enn forskjellene i overflate/størrelse for partiklenes skadelige effekter.

![Figur 2. Oversikt over den typiske størrelsesfordelingen av svevestøv i uteluft og hvilke mekanismer som er involvert i dannelsen av de ulike fraksjonene. Figuren er basert på en fremstilling fra WHO (2006) [6] Figur 2. Oversikt over den typiske størrelsesfordelingen av svevestøv i uteluft og hvilke mekanismer som er involvert i dannelsen av de ulike fraksjonene](/globalassets/bilder/figurer-og-tegninger/uteluft_svevestov_figur-2.png?preset=mainbodywidth&maxwidth=970&width=970)
Dannelsesprosesser for partikler
Størrelsessammensetningen av svevestøv kan også deles inn etter ulike dannelsesprosesser, og vil dermed ha ulik sammensetning. Partiklene i finfraksjonen deles gjerne inn i «primærpartikler» og «sekundærpartikler». Primærpartikler er partikler dannet direkte under forbrenningsreaksjoner ved kondensering av avgasser. Sekundærpartikler er partikler dannet fra gasser som videre reagerer i atmosfæren og danner nye partikler.
Aitkenpartikler (enkeltkjernepartikler) er primære (nydannete) partikler fra eksos eller lignende forbrenningsavgasser, og består hovedsakelig av partikler med størrelse rundt 0,02 µm (se figur 2). Slike partikler observeres hovedsakelig bare i nærheten av den aktuelle kilden, og vokser raskt og danner akkumulasjonspartikler som utgjør den neste størrelsesfraksjonen.
Akkumulerte partikler er gjerne eldre, koagulerte forbrenningspartikler med adsorberte forbindelser, og består hovedsakelig av partikler med størrelse rundt 0,2 µm (0,051 µm). Til sammen utgjør Aitken og (PM102,5, PM2,5 og PM0,1). Det vil derfor kunne forekomme noe mekanisk generert støv i PM2,5, selv om partiklene i denne størrelsesfraksjonen i hovedsak betraktes som forbrenningspartikler. Dessuten kan forbrenningsreaksjoner gi opphav til grove partikler i form av større partikkel aggregater. Med hensyn til kjemisk sammensetning går allikevel det viktigste skillet mellom partikler mindre enn 1 µm, som i hovedsak er dannet fra forbrenningsgasser, og partikler over 1 µm, som normalt stammer fra mekaniske slitasjeprosesser [7, 8].
Partikkelsammensetning
Svevestøv er en kompleks blanding av en rekke forbindelser fra mange forskjellige kilder. Fine forbrenningspartikler består i stor grad av kondenserte hydro karboner og sulfat, samt sotpartikler med en karbonkjerne og spor av metallisk aske dekket av kondenserte organiske forbindelser og sulfat [7]. De organiske forbindelsene utgjør bl.a. polysykliske aromatiske hydrokarboner (PAH) som er beskrevet under Polysykliske aromatiske hydrokarboner (PAH) samt andre organiske forbindelser (kjedete og sykliske hydrokarboner).
De grovere partiklene stammer i stor grad fra slitasje på bildeler (bremser og dekk) og veidekke. Slitasjepartikler fra bremser og dekk inneholder mye metaller som bly, kobber, kadmium og sink, mens uorganiske partikler fra veidekket gjerne er rike på mineraler som silisium, aluminium, kalsium og natrium. Noe organisk materiale som pollen, soppsporer og rester/avfall fra planter og dyr kan også forekomme i grovfraksjonen. Grovfraksjonen vil ofte inneholde endotoksiner som er forbindelser fra celleveggen av gramnegative bakterier [9]. Mengden endotoksiner er ofte større i grovfraksjonen enn andre partikkelfraksjoner.
Enkelte forbindelser som kalium og nitrat forekommer både i fin- og grovfraksjonen. I grovfraksjonen stammer kaliumet hovedsakelig fra jord, mens det i finfraksjonen stammer fra forbrenning av ved. Nitrat i finfraksjonen stammer hovedsakelig fra reaksjoner mellom nitratsyre og ammoniakk, mens det i grovfraksjonen stammer fra reaksjoner mellom nitratsyre og eksisterende grove partikler.
En oversikt over de viktigste forbindelsene i fin- og grovfraksjonen er gitt i tabell 1 og 2.
| Primærpartikler | Sekundærpartikler | |||
| Forbindelse | Naturlige kilder | Antropogene kilder | Naturlige kilder | Antropogene kilder |
|
SO2-4 |
Sjøsprøyt | Forbrenning av fossilt brennstoff | Oksidering av svovelgasser fra hav eller våtmarker; SO2 og H2S fra vulkaner og skogbranner | Oksidering av SO2 fra forbrenning av fossilt brennstoff |
| NO-3 | - | Eksos fra motorkjøretøy | Oksidering fra NOx fra jord, skogbranner eller lynnedslag | Oksidering av NOx fra forbrenning av fossilt brennstoff; eksos fra motorkjøretøyer |
| Mineraler | Erosjon | Veistøv, jordbruk, skogbruk | - | - |
| NH+4 | - | Eksos fra motorkjøretøyer | NH3 fra ville dyr, urørt jord | NH3 fra husdyrhold, kloakk og gjødslet mark |
| Organisk karbon (OC) | Branner | Vedfyring, matlaging, eksos fra motorkjøretøy, slitasje av bildekk | - | - |
| Elementært karbon (EC) | Branner | Vedfyring, matlaging, eksos fra motorkjøretøy | - | - |
| Metaller | Vulkansk aktivitet | Forbrenning av fossilt brennstoff, smelting, slitasje på bremseskiver | - | - |
| Bioaerosoler | Virus, bakterier | - | - | - |
| Primærpartikler | Sekundærpartikler | |||
| Forbindelse | Naturlige kilder | Antropogene kilder | Naturlige kilder | Antropogene kilder |
| Mineraler | Erosjon | Veistøv, jordbruk, skogbruk | - | - |
| Metaller | Erosjon | Slitasje på bildekk og bremseskiver | - | - |
| Saltkrystaller | Sjøsprøyt | Salting av veier | - | - |
| Organisk karbon (OC) | - | Slitasje på bildekk go asfalt | - | - |
| Organiske rester | Plante- og insektfragmenter | - | - | - |
| Bioaerosoler | Pollen, soppsporer, bakterieagglomerater | - | - | - |
Andre partikkelparametere
Selv om det er mest vanlig å dele partikler etter størrelse (PM10, PM2,5), er helseeffekter i flere studier også blitt relatert til ulike mål på forbrenningspartikler. Slike svarte karbonpartikler er blitt målt ved ulike metoder som inkluderer svart røyk (BS), svart karbon (BC), elementært karbon (EC) og absorbans (Abs). BS, BC og Abs viser sterk korrelasjon, mens forholdet til EC varierer mellom ulike land, byer og også innen byer. Basert på et gjennomsnitt fra ulike byer er 10 μg/m3 BS omregnet til 1,1 μg/m3 EC. Organiske karbonforbindelser (OC) måles også, og gir en relativ høy korrelasjon med nivåer av EC. Dette kan bety at de effekter som registreres av svarte karbonpartikler i befolkningsstudier i alle fall delvis skyldes OC. Forholdet mellom EC og OC kan imidlertid variere med lokalisering og tid [10].
Kilder og luftforurensningsnivåer av svevestøv
Sammendrag - kilder og nivåer
Menneskeskapte kilder til svevestøv kan deles inn i stasjonære og mobile kilder. Stasjonære kilder inkluderer ulike forbrenningsanlegg for energiproduksjon, ulike industrier, avfallsbehandling, byggeplasser, erosjons- og veistøv. I en del norske byer og tettsteder kan også vedfyring under spesielle forhold bidra vesentlig til svevestøvnivåene. Mobile kilder bidrar vanligvis mest, særlig dieselkjøretøyer uten partikkelfilter. Langtransportert støv vil kunne bidra betydelig til lokal forurensning. Ved regionale bakgrunnsstasjoner bidrar langtransportert luftforurensning til de målte nivåene av svevestøv. Her ligger konsentrasjonene gjennomsnittlig på 34 µg/m3 for PM2,5 i årsmiddel. Dette gir et langtransportbidrag på 30-40 % ved typiske veinære målestasjoner for årsmiddel. Langtransportert svevestøv gir et vesentlig lavere bidrag til kortvarige høye topper i byene.
Kilder
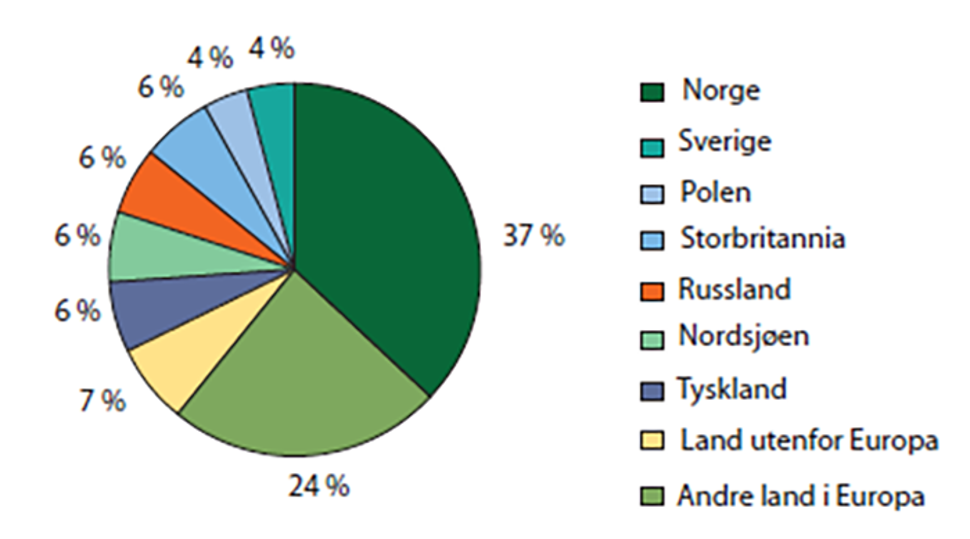
Ettersom svevestøv består av både primære og sekundære partikler, må begge typer utslipp vurderes [4]. De viktigste kildene er oppsummert i tabell 1 og 2 under Partikkelegenskaper. Menneskeskapte kilder kan videre deles inn i stasjonære og mobile kilder. Stasjonære kilder inkluderer ulike forbrenningsanlegg for energiproduksjon, industri eller avfallsbehandling, oppvarming, metall-, mineral-, petrokjemisk og treforedlingsindustri, byggeplasser, erosjons- og veistøv. Mobile kilder er i all hovedsak motorkjøretøyer som danner primærpartikler og slipper ut forløpergasser som kan danne sekundær partikler i atmosfæren. Svevestøv kan også deles inn i lokalt generert støv og langtransportert støv. Langtransportert støv kan bidra betydelig til lokal forurensning, 30-40 % av årsmidlet for PM2,5 er langtransportert ved typiske veinære målestasjoner, mens ved kortvarige høye topper i byene er bidraget vesentlig lavere. I årene 2006-2010 er det vist at 57 % av langtransportert PM2,5 kommer fra kilder utenfor Norge (figur 3).
Trafikk
Forbrenningsmotorer i biler, motorsykler, lastebiler osv. utgjør i dag den viktigste kilden til PM2,5 i de fleste tettbefolkede områder. Dieselmotorer står igjen for størsteparten av disse partikkelutslippene. Ifølge US Environmental Protection Agency (EPA) inneholder dieseleksos over 20 000 kjemiske stoffer, der bare rundt 500 er identifisert, bl.a. CO, CO2, svovel- og nitrogenforbindelser, og en rekke lavmolekylære hydrokarboner som aldehyder, benzen, PAH, nitro-PAH og ulike partikler. Dieseleksospartikler (DEP) består av partikler med en kjerne av elementært karbon og adsorberte hydrokarboner, samt små mengder sulfat, nitrat og metaller. Størrelsesmessig består DEP av fine partikler inkludert store mengder ultrafine partikler (figur 4).
Den viktigste kilden til DEP er veitrafikk. Tidligere var det stort sett lastebiler og busser som var utstyrt med dieselmotorer, men med utviklingen av stadig bedre og mer drivstoffgjerrige dieselmotorer har andelen personbiler med dieselmotor økt mye i europeiske land. DEP kan også stamme fra andre kilder som skip, dieseldrevne lokomotiver og ulike tunge maskiner. Sammenlignet med bensinmotorer er forbrenningsreaksjonene i dieselmotorer langt mer ufullstendige, noe som resulterer i betydelig større utslipp av sotpartikler. Forbedrete forbrenningsprosesser i nyere dieselmotorer og bruk av dieselpartikkelfiltre har imidlertid redusert utslippene fra moderne dieselbiler betydelig.
![Figur 4. Dieseleksospartikler. Figuren er modifisert fra U.S. EPA ”Health effects assessment document for diesel engine exhaust” [11] Figur 4. Dieseleksospartikler. Figuren er modifisert fra U.S. EPA ”Health effects assessment document for diesel engine exhaust” [11]](/globalassets/bilder/figurer-og-tegninger/uteluft_svevestov_figur-4.png?preset=mainbodywidth&maxwidth=970&width=970)
Biltrafikk er også den viktigste kilden til grove partikler, hovedsakelig dannet ved slitasje på veidekket og på bildeler som bremser og dekk. Bruken av piggdekk vinterstid, gjør at Norge og andre tilsvarende områder har et betydelig høyere innslag av mineralpartikler i uteluften enn i andre deler av verden. Målinger blant annet fra Elgeseter gate i Trondheim har vist at over 90 % av veistøvet kan bestå av mineralpartikler fra veidekke [12]. Videre er det blitt undersøkt hvilke evner ulike dekktyper har til å slite veidekket i lukkede omgivelser (ringbaneforsøk). Disse forsøkene viste at piggdekk ga størst slitasje på veidekke og også økte nivåer av støv (spesielt mineralstøv) [13].
Studier fra Sverige har vist at slitasje av vei belagt med granittholdig eller kvartsittholdig asfalt, hovedsakelig ga opphav til grove mineralpartikler bestående av silisium, oksygen, aluminium og kalsium [14]. Slitasje på bremseklosser og bremseskiver førte til dannelse av en betydelig andel metallholdige partikler. Mer enn en tredjedel av den massen som slites av fra bremseklosser ble frigjort i form av svevestøv. Gjennomsnittsstørrelsen til disse partiklene lå på rundt 12 µm, og de besto blant annet av jern, barium og kobber [15]. Bildekkpartikler er en av de viktigste kildene til sink og kadmium i svevestøvet, og kan også inneholde betydelige mengder PAH [16, 17]. En svensk undersøkelse har nylig vist at slitasje av bildekk mot asfalt kan danne ultrafine partikler.
Slitasje på metallpiggene i piggdekk vil trolig også føre til dannelse av metallpartikler, men det foreligger per i dag ingen studier av dette. Videre er det i tunneler med togtrafikk funnet høye nivåer av metallrike partikler [18].
Vedfyring
I Norge er det et betydelig innslag av vedfyringspartikler vinterstid. Det dannes også store mengder «vedfyringspartikler» og forbrenningsgasser under skogbranner. Studier utført ved Folkehelseinstituttet viser at de fysiske og kjemiske egenskapene til vedfyringspartikler skiller seg klart fra forbrenningspartikler fra bilmotorer. Vedfyringspartikler inneholdt bl.a. over hundre ganger høyere nivåer av PAH sammenlignet med dieseleksospartikler og veistøv [19, 20]. Ulike forbrenningsforhold vil kunne påvirke sammensetningen av vedfyringspartiklene [21].
Industri
Selv om det er lite tungindustri igjen i Norge, finnes det fremdeles enkelte områder der industrielle utslipp er hovedkilden til svevestøvforekomster. Eksempelvis har Mo i Rana hatt svært høye nivåer av svevestøv som følge av utslipp fra den metallurgiske industrien [22].
Eksponering og forurensningsnivåer i Norge
Eksponering
Reelle personlige eksponeringsnivåer for svevestøv er vanskelig å beregne. Svevestøvmålinger fra et lite antall målestasjoner brukes ofte for å beskrive situasjonen i et område, og bostedsadresser benyttes som grunnlag for beregning av eksponeringsnivåer. Slike data kan være svært unøyaktige, da den enkeltes aktivitet og oppholdstid i forurensede områder vil variere. Særlig for personer som tilbringer mye tid i rushtrafikken vil denne eksponeringen ha stor betydning for den totale svevestøveksponeringen, rundt 30 til 50 %, beregnet ut fra en irsk undersøkelse [23]. For personer som derimot oppholder seg mye i nærmiljøet vil en lokal målestasjon være et bedre mål på eksponeringen. Dette er for eksempel vist ved studier av eldre i aldershjem hvor det var en høy korrelasjon mellom personbårne målinger, målinger utenfor hjemmet og en sentral målestasjon i nærheten [24].
Mye tyder nå på at svarte karbonpartikler viser større korrelasjon enn PM2,5 for individuell eksponering når faste målestasjoner brukes, og er et bedre mål for forbrenningspartikler enn PM2,5. Partikkelstørrelsen av de svarte karbonpartiklene kan variere, og er avhengig av avstanden til utslippskilden. For eksempel vil svarte karbonpartikler nær en hovedvei inkludere mye ultrafine partikler. Daglig variasjon i svarte karbonpartikler i byer og tettsteder assosieres sterkest med utslipp fra lokal trafikk.
I tillegg til svevstøvkonsentrasjonen i luften vil også deponeringseffektivitet i luftveiene og retensjonstid ha stor betydning for inhalerte partiklers evne til å forårsake helseskade.
Svevestøvnivåer i Norge
Svevestøv er både internasjonalt og i Norge målt ved PM10. Målinger av PM2,5 er nå også innført de fleste steder. Ultrafine partikler (PM0,1) måles ikke rutinemessig, men er forsøksvis blitt målt. Likeledes er måling av svarte karbonpartikler blitt aktualisert i den senere tid.
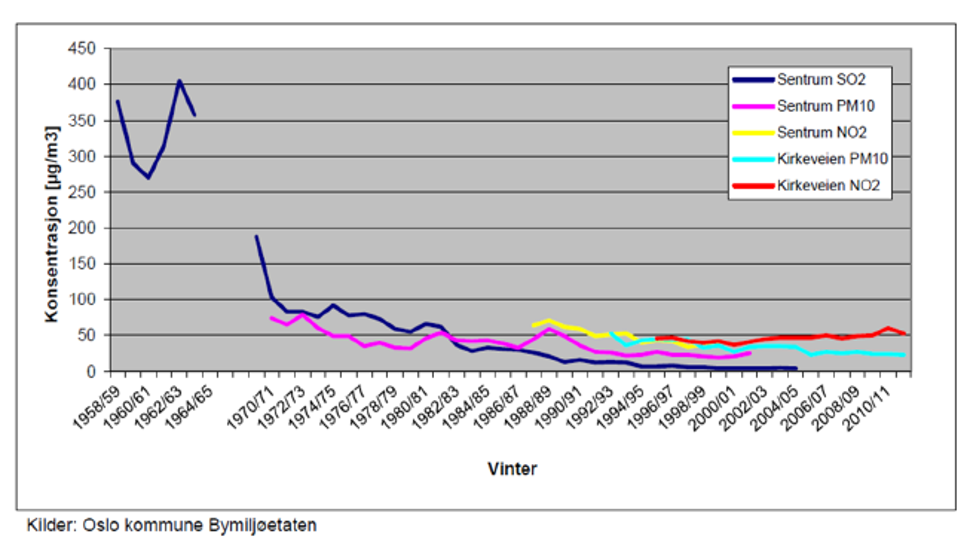
Konsentrasjonene av svevestøv i byer og tettsteder i Norge varierer med utslipp fra ulike kilder, topografiske og klimatiske forhold. Nivåene av svevestøv (PM10) har falt siden 1970-årene, men i mindre grad enn enkelte andre komponenter, som SO2 (se figur 5 fra Oslo). Fra 1990-tallet har PM10-nivåene holdt seg relativt stabile med en svak reduksjon.
I de største byene i Norge er konsentrasjonene fortsatt relativt høye, spesielt på grunn av veitrafikken. De høyeste konsentrasjonene forekommer på kalde dager med tørt vær og tørr veibane i piggdekksesongen. På slike dager er det også liten luftutskiftning, og det kan da forekomme episoder med konsentrasjoner av partikler (PM10) på mellom 100 og 300 μg/m i døgnmiddelkonsentrasjon. For PM2,5 kan det fore komme episoder med konsentrasjoner mellom 50 og 70 µg/m3. PM2,5-konsentrasjonene har enkelte år blitt målt spesielt høye på nyttårsaften, hvor konsentrasjoner over 100 µg/m3 har forekommet. Det er naturlig å tenke seg fyrverkeri som kilde.
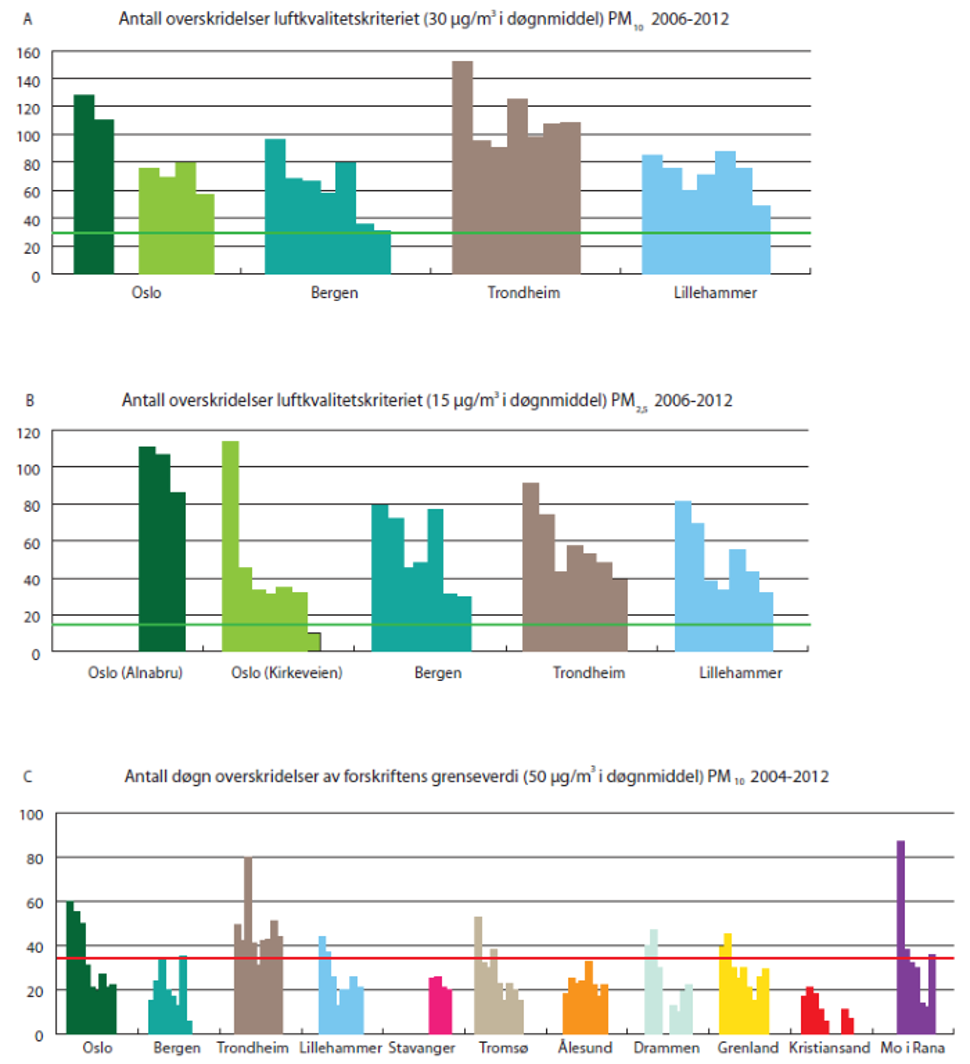
Antall overskridelser av døgnmiddelkonsentrasjonene ved utvalgte veinære stasjoner i Oslo, Bergen, Trondheim og Lillehammer viser opp imot hundre dager med nivåer over luftkvalitetskriteriene på 30 µg/m3 PM10 og 15 µg/m3 PM2,5 (figur 6A og B).
Det er også overskridelser av forskriftsfestede grenseverdier for døgnmiddel PM10 (figur 6 C). Forurensningsforskriftens kapittel 7 om lokal luft kvalitet har grenseverdier for årsmiddel både for PM10 og PM2,5. Årsmiddelverdien for PM10 skal ikke overskride 40 µg/m3, mens døgnmiddelverdien ikke skal overskride 50 µg/m3 mer enn 35 ganger i et kalenderår for PM10. Grenseverdien for PM2,5 er 25 µg/m i årsmiddel.
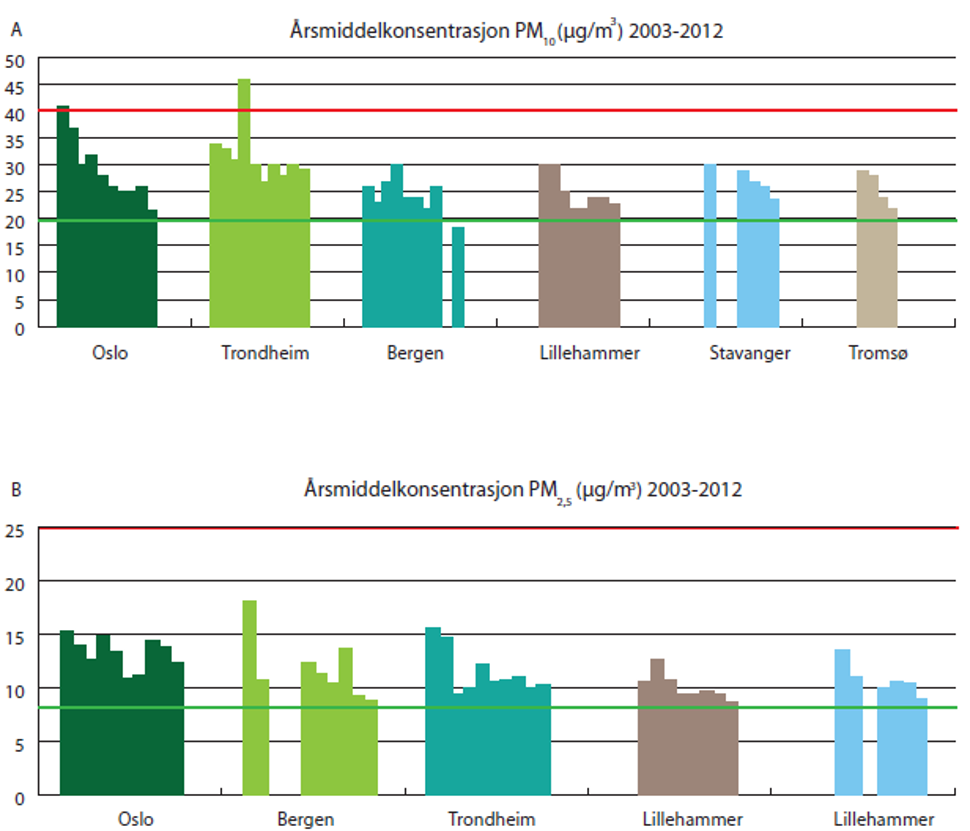
Tidlig på 2000-tallet var det overskridelser av grenseverdiene for døgnmiddel i flere norske byer, men siden har antall overskridelser gått ned. I 2012 hadde Trondheim og Mo i Rana mer enn 35 døgnmidler over 50 µg/m3. Beregninger for 2007, utført av Norsk institutt for luftforskning (NILU), viser at mange mennesker er utsatt for helseskadelig luftforurensning i Oslo og Trondheim.
I de fleste byer i Norge er det et mindre problem med å oppfylle grenseverdiene for årsgjennomsnittet for PM10 (figur 7A) og PM2,5 (figur 7B), mens luftkvalitetskriterienes årsmiddelverdi for begge komponentene overskrides i de fleste byene. PM2,5-konsentrasjonene kan også være høye på kalde, tørre vinterdager, med liten luftutskiftning. Siden PM2,5 ble inkludert på et senere tidspunkt i forskriftene for lokal luftkvalitet, er det foretatt langt færre rutinemessige målinger av denne størrelsesfraksjonen.
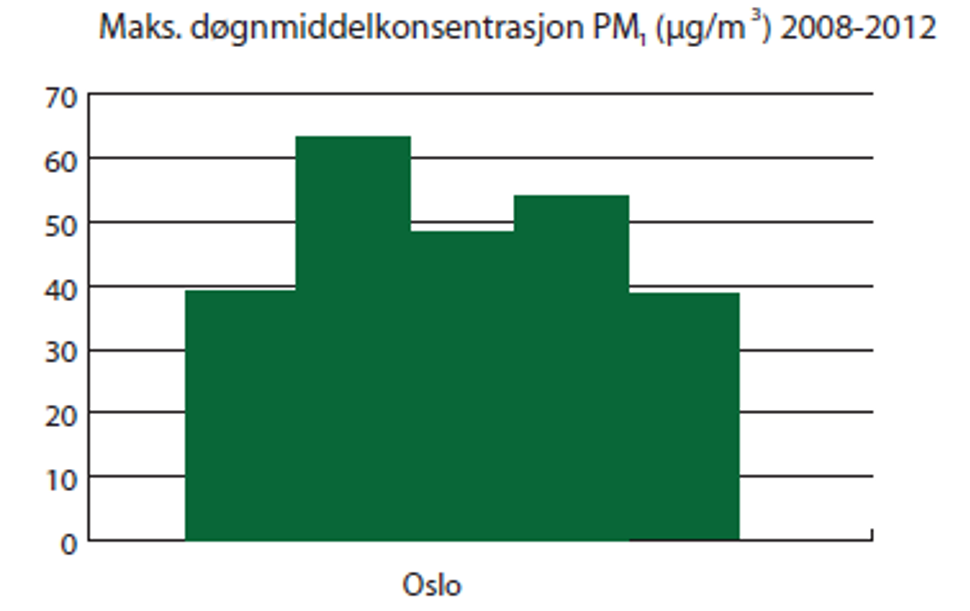
Det er gjort enkelte målinger på partikler med aero dynamisk diameter lik og under 1 µm (PM1) i Norge. Årsmiddelkonsentrasjonen av PM1 var 10 µg/m3 i Oslo i 2011, dette nivået er tilsvarende som for PM2,5. Maksimum døgnmiddelkonsentrasjon av PM1 i Oslo lå mellom 40 og 60 µg/m3 i perioden 2008 til 2012, som vist i figur 8.
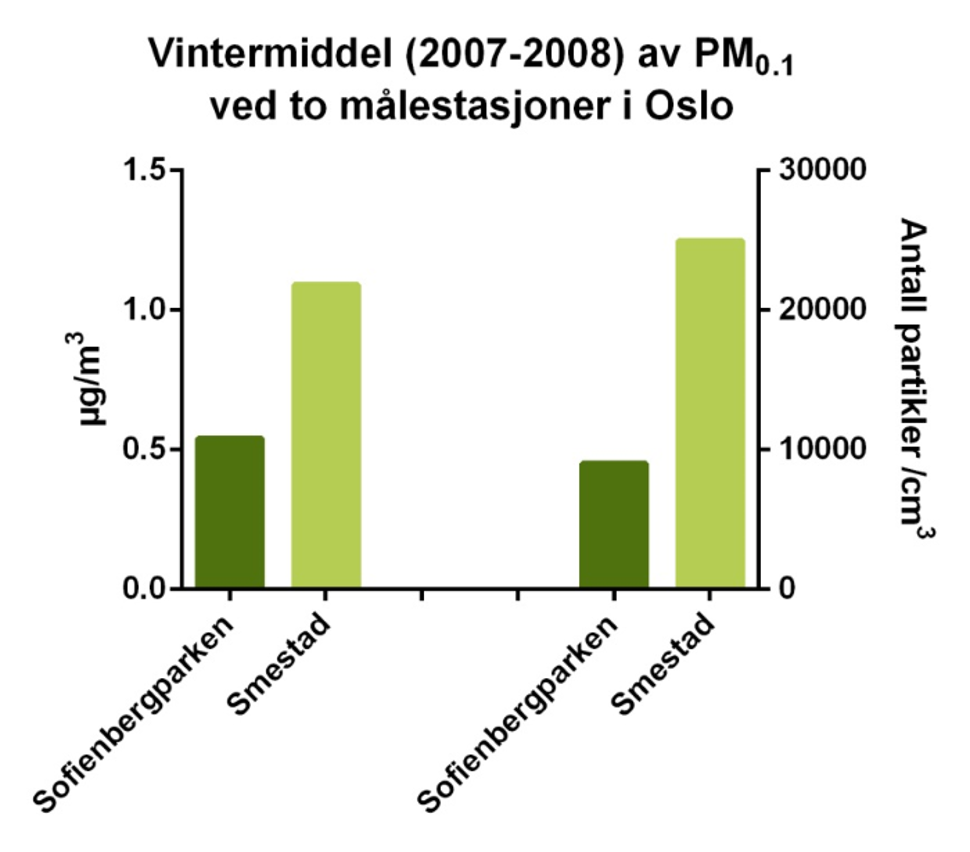
Da det har vært økende interesse for PM0,1-fraksjonen, har det forsøksvis vært foretatt målinger ved enkelte målestasjoner i Oslo. Disse viser at målestasjonen med mye biltrafikk ga høyere nivåer av PM0,1 (både for masse og antall partikler) enn bybakgrunn (figur 9).
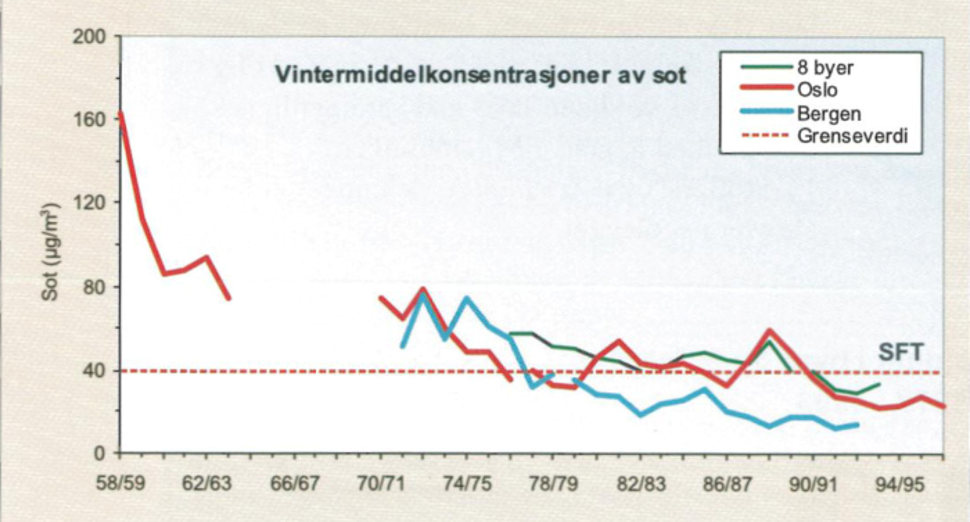
Før man innførte målinger av PM10 og PM2,5 var det konsentrasjonen av sot som ble målt i Norge. Derfor viser målingene på partikler i Norge fra 1950-tallet og frem til 1990-tallet sotnivåene. Vintermiddelkonsentrasjonene viser en kraftig reduksjon i nivåene fra slutten av 1950-tallet til starten av 1960-tallet (figur 10). Disse reduksjonene skyldes overgang fra bruk av koks og kull til bruk av fyringsoljer og elektrisitet til boligoppvarming. Det var også reduserte utslipp fra industrien i denne perioden. Sotnivåene viste videre en jevn nedgang fra 1977 til 1983. Årsaken til denne reduksjonen er mest sannsynlig redusert bruk av fyringsoljer. Fra 1983 har det vært en stabilisering av nivåene [25].
I en ny stor europeisk studie (ESCAPE) ble svevestøvnivåene i Oslo og en rekke andre byer sammenlignet i perioden 2008-2011. Et stort antall målesteder, som inkluderte både gate og bakgrunnsstasjoner, ble brukt i hver by. For å sikre mest mulig sammenlignbare målinger i de ulike byene ble det benyttet standardiserte metoder for måling, og analysene ble foretatt i et laboratorium. PM10, PM2,5 og grovfraksjonen ble beregnet ut i fra målinger fra flere årstider og vil ikke være representative for årsmidlene ved de ulike målestasjonene som har kontinuerlige målinger over hele året. Målingene viste store variasjoner mellom ulike byer i Europa, og også store variasjoner innen byene. Konsentrasjonene i Oslo for alle PM-fraksjonene var på omtrent samme nivå som i andre nordiske hoved steder, men lavere enn i de fleste større byer ellers i Europa [26]. For PM10 var de beregnede gjennomsnittlige årsverdiene i Oslo på 14,8 µg/m3, for PM2,5 på 8,6 µg/m3 og for grovfraksjonen på 6,1 µg/m3. Det er viktig å merke seg at de beregnende gjennomsnittskonsentrasjonene for Oslo var vesentlig lavere enn årsmiddelkonsentrasjon målt for tilsvarende år (figur 7). Dette kan skyldes at i figurene er bare den målestasjonen med høyest årsmiddel angitt, mens målingene i ESCAPE-studien også inkluderte bakgrunnsstasjoner. I tillegg ble målingene i ESCAPE foretatt over kortere perioder, og årsmidlet ble beregnet ut fra dette.
Helseeffekter av svevestøv
Helseeffekter av svevestøv er blitt studert ved eksperimentelle studier på cellemodeller, dyr og mennesker, samt befolkningsstudier. De tidligste befolkningsstudiene på helseeffekter av svevestøv fokuserte i hovedsak på astma, kronisk obstruktive lungesykdommer (KOLS), lungekapasitet/-funksjon og respiratoriske symptomer. De siste tiårene er det også vist sammenheng mellom eksponering for svevestøv og utvikling av hjerte- og karsykdom. Selv om de underliggende mekanismene er uklare, foreligger betydelige bevisbyrder som setter eksponering for svevestøv i sammenheng med utvikling og forverring av disse sykdommene. Nyere studier har også fokusert på effekter av svevestøv i sentralnervesystemet, på fosterutvikling, samt stoffskifteforstyrrelser (som diabetes og fedme).
Avsetning og fjerning av partikler
Sammendrag - avsetning og fjerning av partikler
Svevestøv (PM10) vil deponeres og fjernes fra luftveiene i varierende grad avhengig av partikkelstørrelsen. Grovfraksjonen (PM10-2,5) avsettes hovedsakelig i de øvre luftveiene (nese, svelg, luftrør), men også til en viss grad i den perifere regionen. Finfraksjonen (PM2,5) inkludert mesteparten av de ultrafine partiklene avsettes hovedsakelig i lungeblærene, mens de aller minste partiklene (< 0,01 µm) vil avsettes i nese/svelg. Ulike sykdomstilstander (astma, KOLS) samt fysisk aktivitet påvirker avsetningen av partikler i luftveiene. Partiklene som trenger dypt ned i lungeblærene kan forbli der i lengre tid (måneder) før de er fjernet. Det er omdiskutert i hvor stor grad de ultrafine partiklene passerer over til sirkulasjonen, og også til sentralnervesystemet.
Lungene eksponeres kontinuerlig for ulike fremmedlegemer (partikler og mikrober) som avsettes ved inhalasjon. Luftveiene har derfor velutviklede rensemekanismer.
Avsetning i luftveiene
Inhalerte partikler med aerodynamisk diameter over 10 µm avsettes hovedsakelig i nese og svelg. Partiklene i PM10-fraksjonen kan deponeres dypere ned i luftveiene. Grovfraksjonen (PM10-2,5) avsettes hovedsakelig i de øvre luftveiene (nese, svelg, luftrør), men også til en viss grad i den perifere regionen (finere luftrørsforgreininger, bronkioler og lungeblærer). Finfraksjonen (PM2,5) avsettes hovedsakelig i lungeblærene. Data tyder på at de minste partiklene i størrelsesorden 0,1-1,0 µm generelt har en lav avsettingseffektivitet, ved at størsteparten av disse partiklene forsvinner ut av luftveiene ved utpust. Videre vil de aller minste nanopartiklene (< 0,01 µm) hovedsakelig avsettes i nese/svelg [8].
Partikler avsettes dessuten ikke jevnt fordelt i luftveiene, men oppkonsentreres i enkelte områder. Studier viser at størsteparten av partiklene som avsettes i lungene, gjør dette i forgreiningspunktene i bronkier og bronkioler. Slike små avgrensede områder av lungevev kan dermed motta mye større doser av partikler enn andre områder [27].
Avsetning av partiklene i luftveiene påvirkes videre av en rekke individuelle faktorer. Eksisterende lungesykdom som astma og KOLS kan øke avsetningen av partikler i lungene. Personer med disse sykdommene ansees i utgangspunktet å være mer utsatt for helseeffekter av svevestøv, og vil i tillegg risikere å få avsatt en større andel av svevestøvet i lungene enn friske [28, 29]. Avsetningsgraden ser også ut til å være aldersavhengig, barn og spesielt spedbarn har høyere avsetning enn voksne [30]. Barn synes videre å være mer utsatt for skade av svevestøv enn voksne, trolig også fordi lungene ennå ikke er fullt utviklet.
Personens aktivitetsnivå påvirker også avsetningen av partikler i luftveiene. En betydelig større andel partikler i alle størrelsesfraksjoner vil avsettes i lungene ved et høyt aktivitetsnivå. Først og fremst skyldes dette økt mengde innåndet luft under fysisk aktivitet, slik at langt flere partikler inhaleres. Dessuten vil høy aktivitet kreve mer pusting gjennom munnen, og dermed gi mindre effektiv bortfiltrering av partikler sammenlignet med nesepusting. I tillegg vil man inhalere dypere,slik at større deler av lungene eksponeres. Ved hvile avsettes PM2,5 mer effektivt enn PM10-2,5. Dette forholdet synes å endre seg med aktivitetsnivå og pustefrekvens, slik at ved trening vil spesielt de største partiklene i PM10-2,5-fraksjonen avsettes mest effektivt [31].
Fjerning av partiklene fra luftveiene
Desto lengre partikler forblir i lungene etter avsetning, jo lengre kan de utøve skade på lungevevet. Fjerning (”clearance”) av partikler avsatt i luftveiene foregår hovedsakelig ved to prosesser; kjemisk oppløsning eller fysisk transport. Den første mekanismen er begrenset til biologisk løselige partikler eller forbindelser på partikler som enten er fettløselige eller løselig i kroppens væsker. Løselige forbindelser vil normalt fjernes via blod eller lymfesystemet, og denne formen for fjerning av inhalerte forbindelser kan foregå overalt i luftveiene. Fjerning av uløselige partikler ved fysisk transport involverer ulike mekanismer i de ulike delene av lungene.
Partikler som avsettes i nese, luftrør, og bronkier/bronkioler fjernes relativt raskt via ”slimheisen” («mucusciliær transport»), mens partikler som avsettes i lungeblærene i hovedsak fjernes av makrofager (spiseceller). Makrofager fulle av partikler, vandrer så oppover luftveiene til de når ”slimheisen”. Fjerning av partikler fra lungeblærene går betydelig langsommere enn lengre oppe i luftveiene, og kan ta opptil flere måneder [32]. Partikler som avsettes i lungeblærene antas derfor å kunne gjøre mer skade ettersom de kan forbli i lungene i lengre tid.
Makrofager ser ut til å ha mindre evne til å fange opp og fjerne ultrafine partikler (PM0,1), sammenlignet med fine og grove partikler. Ultrafine partikler vil derfor trolig forbli i alveolene i lengre tid enn større partikler. Dette øker både sannsynligheten for å irritere/skade lungevevet, og også for at ultrafine partikler tas opp eller passerer mellom epitelcellene, og overføres til blodårene. Dersom inhalerte partikler overføres til blodbanen, vil en rekke organer kunne bli eksponert for partiklene. Det fokuseres spesielt på mulige effekter på cellene i blodåreveggene (endotelceller) og hjertet, som er det første organet blodstrømmen fra lungene passerer. Andre organer som sentralnervesystemet, lever, milt og nyrer kan også tenkes å bli eksponert.
Det er imidlertid svært omdiskutert om ultrafine partikler faktisk passerer fra lungene og over i blodbanen i tilstrekkelige konsentrasjoner til å kunne forårsake helseeffekter. Enkelte studier tilsier at majoriteten av partiklene inklusiv de ultrafine forblir i lungevevet, og at bare ubetydelige mengder går over i sirkulasjonssystemet [33].
Selv om størsteparten av de ultrafine partiklene avsettes i lungeblærene, er den totale overflaten av denne delen av lungene ekstremt stor, og konsentrasjonen av partiklene per overflateareal blir derfor relativ lav (0,1 ng/cm2). I nese og svelg avsettes derimot betydelig høyere konsentrasjoner (opptil 100 ng/cm2) av ultrafine partikler [34]. Nyere forskning tyder på at ultrafine partikler kan tas opp i nesen og fraktes via luktenerven til hjernen [35, 36].
Fine og grove partikler antas i langt mindre grad å kunne overføres fra lunge til andre vev, enn ultrafine partikler. Løselige forbindelser på partikkeloverflaten kan derimot frigjøres, gå over i sirkulasjonssystemet og nå andre organer. Dette gjelder spesielt vannløselige forbindelser som metaller [37].
Mekanismer for helseskadelige effekter av svevestøv
Eksponering for svevestøv kan føre til betennelse i luftveiene. Vanligvis er slike betennelsesprosesser beskyttende, men ved for sterk eller vedvarende stimulering synes betennelsen å være sentral i utvikling av lungesykdommer, og også spille en rolle i utvikling av karsykdommer. Betennelse synes å være involvert i forverring av lunge- og hjerte- og karsykdom.
Inhalasjon regnes som viktigste eksponeringsvei for svevestøv. Cellene i luftveiene er de første som kommer i kontakt med svevestøvpartikler som blir avsatt i lungene. Aktivering av betennelsesreaksjoner antas å spille en nøkkelrolle i utviklingen av helseeffekter. Svevestøvseksponering vil kunne aktivere produksjon av betennelsesstoffer som cytokiner og kjemokiner. Disse skilles ut fra lungecellene og tiltrekker celler fra immunforsvaret. Betennelsesreaksjonen som utløses er egentlig en forsvarsmekanisme, men kan komme ut av kontroll og bli kronisk. Kroniske betennelsesreaksjoner vil kunne føre til skade på arvematerialet (DNA), endret cellevekst og celledød, som igjen kan føre til varige vevsforandringer og utvikling av lungesykdom.
Effektene av svevestøvpartikler kan skyldes direkte effekter av partiklene og/eller løselige partikkelkomponenter på målcellene, eller skyldes utslipp av skadelige stoffer fra aktiverte immunceller. Både partikkelkjernen og løselige forbindelser som metaller og PAH kan danne reaktive oksygenforbindelser frie radikaler) som kan skade cellene, eller stimulere reseptorer (mottakerproteiner) på celleoverflaten [38]. En del løselige forbindelser vil også kunne påvirke faktorer inne i cellene, som cellenes DNA. Cytokiner og vekstfaktorer kan også forårsake økt vekst av muskel og bindevevsceller i lungene som over tid kan føre til innsnevring av luftveiene og redusert gassutveksling, og symptomer på obstruktive lungesykdommer som astma og KOLS.
Svevestøv kan føre til hjerte- og karsykdom. Mekanismen for dette er imidlertid uklar, men flere mulige hypoteser er reist (se modell i figur 11).

Dyrestudier og celleforsøk
Sammendrag - dyrestudier og celleforsøk
Betydningen av ulike partikkelstørrelser, overflateegenskaper samt effekter av partikler fra en rekke ulike spesifikke kilder og byluftpartikler er undersøkt i både cellekultur og dyremodeller. Slike studier viser at svevestøv kan påvirke funksjonen til luftveiene og hjerte-karsystemet. Nyere studier indikerer også effekter i hjernen. Små partikler (ultrafine/fine) har et relativt stort overflateareal, og er ofte mer toksiske enn større partikler av samme sammensetning. For partikler med ulik sammensetning vil overflatereaktiviteten ofte være vel så viktig.
Dieseleksospartikler (DEP) er vist å gi oksidativt stress, celledød, DNA-skade og betennelsesreaksjoner, samt forsterkete allergiske responser i luftveiene. Videre er DEP vist å kunne forårsake blodpropp og hjerterytmeforstyrrelser i dyremodeller. Partikler fra andre drivstoffer som bensin og biodiesel synes å gi mye de samme effektene ved eksponering for tilsvarende masse, men dette avhenger av kilde for biodiesel, type DEP, blandingsforhold mellom biodiesel og DEP, samt motor og renseteknologi. Vedfyringspartikler synes noe mindre potente til å utløse betennelsesresponser. Slitasjepartikler fra veidekke (mineralpartikler) og fra kjøretøy (dekk og metallrike bremsepartikler) gir også akutte betennelsesreaksjoner i luftveiene. Alle disse kildene bidrar til svevestøvet i byluft.
Forsøk med konsentrerte byluftpartikler (CAPs, PM2,5) i dyr, er vist å gi betennelsesreaksjoner i luftveiene, endringer i hjertefrekvensen, økt plakkdannelse i blodårer, samt endringer i hjernens morfologi og funksjon. For kortidseksponering (timer, døgn) er det funnet effekter fra ca 200 µg/m3 CAPs, mens ved eksponering i lengre tid (uker, måneder) er det funnet effekter ved nivåer også under 100 µg/m3 CAPs.
Eksperimentelle studier med forsøksdyr og cellekulturer fra mennesker og dyr viser at svevestøv kan påvirke funksjonen til lunge, blodårer og hjerte. Helt nye studier indikerer også at de minste svevestøvspartiklene kan forårsake effekter i hjernen. Disse eksperimentelle studiene har imidlertid den begrensningen at de i langt mindre grad fanger opp effekter hos de mest mottagelige/utsatte individene i befolkningen, og man må derfor ofte benytte langt høyere partikkelkonsentrasjoner enn de reelle eksponeringsnivåene for svevestøv i forurenset byluft. En usikkerhet ved dette er hvorvidt effekter observert ved slike kunstig høye konsentrasjoner av svevestøv er representative.
I de aller fleste av slike eksperimentelle studier har eksponeringen vært kortvarig, men det finnes et fåtall dyrestudier av lengre varighet.
Ulike partikkelstørrelser, overflate- egenskaper og partikkelantall
De ulike størrelsesfraksjonene av svevestøv PM10-2,5 (grov), PM2,5 (fin) og PM0,1 (ultrafin) har ulike fysiske og kjemiske egenskaper. Biologiske responser og skadelige effekter av disse størrelsesfraksjonene har vært studert både i dyrestudier og i cellekulturer. Også modellpartikler med samme kjemiske struktur, men med størrelser fra nano- til mikrometerområdet, har vært undersøkt, spesielt med hensyn til betennelsesreaksjoner.
Ved instillering (plassering i luftveiene) viser de fleste av disse studiene at de minste partiklene (PM2,5/PM0,1) har større potensial til å gi betennelsesreaksjoner i lungene enn større partikler med samme kjemiske struktur. Denne forskjellen i respons forsvinner imidlertid ofte når det justeres for det større overflatearealet hos de minste partiklene. Derfor blir partikkeloverflatearealet sett på som svært viktig for å utløse betennelsesreaksjoner [39]. Tilsvarende er vist i humane lungeceller i kultur [40].
Selv om overflatearealet synes viktig for utløsning av biologiske responser, er det flere studier som tyder på at overflatereaktivitet kan spille en enda viktigere rolle, spesielt ved forskjellig type partikler med tilsvarende overflateareal [41, 42]. Studier kan tyde på at for lite toksiske partikler er overflatearealet viktigst for utløsning av respons, mens for mer toksiske partikler vil betydningen av overflatereaktivitet dominere over overflateareal. Denne kunnskapen gjør at det kan stilles spørsmål ved bruk av partikkelmasse som en parameter ved fastsettelse av grenseverdier for svevestøv, og at overflateareal kan være bedre å bruke, spesielt for lite toksiske partikler.
Når det gjelder ulike størrelsesfraksjoner av byluftpartikler er bildet mer komplisert. I studier hvor forskjellige størrelsesfraksjoner av PM samlet inn i samme område er sammenlignet, synes det som at grovfraksjonen (PM10-2,5) er mer potent til å utløse betennelsesresponser enn PM2,5 og PM0,1 [8].
Partikkelstørrelse kan også ha betydning for effekter av svevestøv i hjerte-karsystemet, men dette har vært mindre studert. Ultrafine partikler kan overføres fra luftveiene til blodbanen [43], men mye tyder på at det skjer i liten grad [44]. En alternativ hypotese til en direkte effekt av partikler av nanostørrelse på hjerte-karsystemet er at betennelsesstoffer som dannes i lungevevet ved partikkeleksponering når blodbanen og dermed utløser effekter på hjerte-karsystemet. I så fall vil partikkelens potensial til å gi betennelsesreaksjoner i lunge, som overflateareal og reaktivitet, være avgjørende. En slik indirekte mekanisme støttes av studier foretatt ved Folkehelseinstituttet, hvor frigjøring av betennelsesstoffer fra lunge påvirker hjerteceller [45]. En tredje mulighet er at partikler kan ha bundet komponenter, som metaller eller organiske forbindelser, og disse kan frigjøres fra partiklene, nå blodbanen og forårsake direkte effekter på hjerte-karsystemet. Siden små partikler med stort overflateareal kan binde større mengder av forskjellige forbindelser, har de dermed et stort potensial til å gi slike effekter sammenlignet med større partikler.
De aller minste partiklene, ultrafine partikler, er foreslått å kunne tas opp i nesen via luktenerven til hjernen, og der aktivere betennelsesreaksjoner [35, 36]. Betennelsesreaksjoner i hjernen er assosiert med utvikling av nevrologiske sykdommer som Alzheimers [46].
Alternativt til masse og overflateareal kan partikkelantall være et bedre mål for eksponering for partikler. Nylig ble det publisert en studie hvor friske frivillige ble eksponert for uteluft på flere ulike lokaliteter og undersøkt for endringer i lungefunksjon. Det ble da funnet en korrelasjon mellom lungefunksjon og partikkelantall, men ikke med massen av PM10 eller PM2,5 [47].
Partikler fra ulike kilder
Svevestøv kan komme fra en rekke forskjellige kilder, både fra forbrenningsprosesser og slitasje av ulike typer materialer. Slike partikler kan derfor ha svært ulik størrelse og fysiskkjemiske egenskaper. Siden det er vanskelig å undersøke betydningen av svevestøv fra ulike kilder i befolkningsstudier, blir eksperimentelle studier svært viktige for å forstå betydningen av enkeltkilder. I tillegg til enkeltkilder, beskrives også byluftpartikler i dette avsnittet. Byluftpartikler domineres svært ofte av trafikk, men også andre kilder kan bidra.
Dieseleksospartikler (DEP)
Det er gjort en rekke eksperimentelle studier på effekter av DEP, både i dyreforsøk og i cellekulturer [38]. Majoriteten av studiene har benyttet gamle partikler og ikke fersklaget DEP, og i de fleste dyrestudiene er det benyttet relativt høye eksponeringsnivåer, noe som begrenser nytten av disse studiene. Det synes som at det er svært store forskjeller i biologiske responser mellom ulike typer DEP. Mange av studiene viser en endring av betennelsesprosesser i luftveiene. DEP aktiverer en rekke signalveier som kan føre til DNA-skade, celledød, dannelse av reaktive oksygenforbindelser og betennelsesstoffer. Korttidseksponering for DEP er vist å stimulere dannelse av betennelsesstoffer i lungecellekulturer og i forsøksdyr [48]. Dessuten er kortvarig eksponering i forsøksdyr vist å øke følsomheten for sympinfeksjoner.
Endringer i pustefrekvens og luftveisreaktivitet er også observert etter korttidseksponering for dieseleksos, og irritasjoner via nervesystemet er foreslått å være involvert [8]. Videre har langvarig inhalasjonseksponering gitt doseavhengige betennelsesreaksjoner og lungeskader i flere dyrearter.
Betydningen av DEP for allergiutvikling har også vært viktig i mange studier. DEP og organiske DEP-ekstrakter er vist å forsterke produksjonen av immunoglobulin E hos mus immunisert med pollen og andre allergener. Immunoglobuliner spiller en viktig rolle i allergiresponser, og funnene tyder derfor på at DEP kan forsterke allergiske reaksjoner aktivert av andre stoffer. Både organiske DEP-ekstrakter og vasket DEP (uten organiske forbindelser) ser ut til å være involvert i disse responsene, noe som tyder på at både partikkelkjernen og organiske forbindelser kan tenkes å spille en rolle i allergiresponser [38, 48]. Senere studier med dyr og celleforsøk har gått inn på hvilke mekanismer som er involvert [49, 50].
DEP er også vist å kunne gi effekter som kan ha betydning for utvikling og forverring av hjerte- og karsykdommer. Studier har vist at DEP kan forårsake blodproppdannelse (trombose) i forsøk med hamster [51, 52]. DEP og organiske DEP-ekstrakter er også vist å fremkalle arytmier i rotter og mus [53, 54]. Både arytmier og trombotiske reaksjoner skjedde samtidig med betennelsesresponser. Eksponering for dieseleksos (350 µg/m3 i 4 timer) førte til økt sammentrekning av blodkar (vener) [55]. Studier tyder også på at hjertets kontraksjonskraft påvirkes av DEP, kort tid etter eksponering [8].
I spesielle mus som er sensitive for hjerte- og karsykdom (ApoE/ mus), er det observert at dieseleksos også induserer endringer i hjertets elektriske aktivitet, men disse effektene ble ikke endret av å filtrere vekk partiklene, noe som tyder på at gassene i eksosen var årsaken til responsene i denne studien [56]. Inhalasjon av dieseleksos hos mus over en 4 ukers periode ga svekket læring, samt endringer i uttrykk av gener som har betydning for hukommelse og betennelsesreaksjoner [57]. Dyreforsøk har også vist at eksponering for dieseleksos i høye konsentrasjoner i fosterlivet reduserte fødselsvekten hos avkommet. Dessuten er det også observert påvirkning av utviklingen etter fødsel, bl.a redusert reproduksjonsevne hos mannlige avkom [8].
En rekke studier viser at DEP er mutagent og gentoksisk. Flere studier i rotte har også vist at langvarig inhalasjon for høye konsentrasjoner av dieseleksos førte til kreft hos rotter. Betydningen av disse undersøkelsene har imidlertid vært omdiskutert, ettersom det er brukt høye doser, og at tilsvarende kreftutvikling ikke er observert i andre dyrearter. IARC (International Agency for Research on Cancer) konkluderte i 2012 at det forelå tilstrekkelig bevis for at dieseleksos er kreftfremkallende for mennesker [58], se avsnitt om dieseleksospartikler under Svevestøv fra ulike kilder, lenger ned på siden.
Bensineksospartikler
Sammenlignet med dieseleksos foreligger det svært få studier som har undersøkt mulige helseeffekter av bensineksos eller bensineksospartikler. Bensineksos er funnet å forårsake betennelsesreaksjoner og effekter på blodårene i forskjellige modellsystemer av gnagere, mens den generelle toksisiteten ikke økte [59]. Sammenligning av diesel- og bensineksospartikler i rotteforsøk ga lignende effekter for toksisitet, mens betennelsesreaksjonene var litt større for diesel enn for bensinpartikler [60].
Ved bruk av en musemodell som er sensitiv for hjerte- og karsykdom ble det påvist at bensineksos kan påvirke hjertets elektriske aktivitet, og øke nivået av faktorer (endotelin-1) som kan forårsake blodåresammentrekninger og dermed øke blodtrykket, samt indikatorer på oksidativt stress [61, 62]. Bortfiltrering av partiklene endret imidlertid ikke responsene, og indikerer dermed at effektene kan skyldes eksosgasser og ikke partikkelfraksjonen [62].
Eksponering av rotter og mus for bensineksos (59 µg/m3 PM) i perioder opptil 6 måneder ga noen små endringer i lungene (proteinlekkasje, redusert funksjon av ”spiseceller”, endringer av DNA). Disse effektene forsvant da bensineksosen ble filtrert [63]. Bensineksospartikler fra en motorsykkelmotor ga betennelsesreaksjoner og hypersensitivitet i lungene på mus [64].
Alternative drivstoff og moderne rensingsteknologier
Kunnskap om helseeffekter av utslipp fra biodiesel og ved bruk av ulike typer renseteknologi er svært liten. Bruk av dieselpartikkelfilter, og også biodiesel som drivstoff i stedet for diesel, synes imidlertid å redusere effektene [65-68]. De foreliggende studier av det helseskadelige potensialet av biodieseleksospartiklene versus DEP viser varierende resultater.
En studie av Brito og medarbeidere [69] viser at mus eksponert for utslipp av biodieselpartikler fikk like mye eller mer betennelsesreaksjoner i lungene og i sirkulasjonssystemet sammenlignet med DEP. I en annen studie ble det imidlertid vist at biodieselpartikler enten var like eller mindre potente enn DEP, avhengig av om det var betennelsesreaksjoner, celledød, gentoksisitet eller oksidativt stress som ble undersøkt [68]. Variasjon i resultatene kan tilskrives mange faktorer; som kilden for biodiesel, type DEP, bruk av filter eller ikke, ny versus gammel motorteknologi (Eurokrav), og ikke minst innblandingsgrad av biodiesel med diesel. Både størrelsen, sammensetningen og antall/mengde partikler som slippes ut vil være av betydning.
Vedfyringspartikler
Eksperimentelle studier tyder på at vedfyringspartikler forårsaker betennelsesreaksjoner og oksidativt stress i luftveiene. En serie studier med korttids- og middels langvarig eksponering av forsøksdyr for vedfyringsrøyk har vist svake effekter på betennelse og toksisitet, immunforsvaret, hjerte-karsystemet og kreftfremkallende potensial [8, 70-72]. En sammenligning av vedfyring og trafikkrelaterte partikler i cellekulturer og ved inhalasjon i rotter viser at disse partiklene induserer forskjellige biologiske responser [73, 74]. Eksponering av rotter for finfraksjoner av PM fra et område, dominert av andre forbrenningspartikler enn trafikk, deriblant vedfyring, hadde mindre effekt på betennelsesreaksjoner i luftveiene enn partikler fra områder dominert av trafikk [68]. Videre forsøk viser at forbrenningsbetingelsene har betydning for det helseskadelige potensialet av vedfyringspartikler [75].
Slitasjepartikler fra veidekke
Veistøv har også vist å kunne utløse betennelsesreaksjoner i lungecellekulturer [70, 76]. Disse partiklene stammet fra veidekke og sandstrøing, og besto hovedsakelig av krystallinske mineraler. Folkehelseinstituttet har i samarbeid med Vegdirektoratet og SINTEF, utført en rekke studier i cellekulturer og på rotter, med mineralpartikler fra bergarter som ofte brukes i norske veidekker. Studiene viste at flere av disse partiklene kan aktivere betennelsesresponser og toksisitet, men at det er store variasjoner mellom partikler fra ulike bergarter. Mineralsammensetningen av partiklene synes avgjørende for deres evne til å gi biologiske effekter, men det er ennå usikkert hvilke mineraler eller kjemiske elementer som forårsaker de skadelige responsene [19, 20, 76-80]. Imidlertid ser det ut til at feltspatmineraler er lite reaktive, og at bergarter med et høyt feltspatinnhold har liten evne til å aktivere betennelsesreaksjoner i lungeceller [80].
Slitasjepartikler fra bildekk og bremseskiver
Metallrike partikler (høyt nivå av kobber, barium og jern) fra bremseslitasje antas å være viktige for helseeffektene av trafikkrelatert svevestøv, men det fore ligger få studier som spesifikt har undersøkt effekten av slike partikler. Bildekk er en annen kilde til slitasjepartikler. Partikler fra bildekk, med høyt innhold av sink og PAH, er vist å gi DNA-skader i lungecellekulturer [81, 82]. Partikler fra bildekk er også vist å gi akutte betennelsesreaksjoner i lungene til rotter, men påvirket ikke markører for hjerteskade [83]. Allergiske reaksjoner mot latex (gummi), som også er en viktig bestanddel av bildekk, er velkjent. Særlig er kontaktallergi ved bruk av for eksempel gummihansker hyppig rapportert. Det er imidlertid lite sannsynlig at inhalasjon av latexpartikler ved de konsentrasjoner som forekommer i uteluft kan føre til luftveisplager [84].
En toksikologisk studie av grovt og fint svevestøv samlet fra lokaliteter med ulik trafikkbelastning, indikerte at prøver fra områder med høy trafikkbelastning generelt ga større effekter på lunge-karsystemet til eksponerte rotter. Innholdet av sink var signifikant relatert til effekter på celledød, mens kobber og barium var signifikant relatert til askorbatnivået (antioksidant som kan indikere mulig lungeskade eller betennelse) i lungene til de eksponerte rottene [85].
Metallrike industripartikler
Metallrike partikler fra områder med mye smelteverk og stålindustri er vist å være mer potente enn andre partikler i å utløse helseeffekter. Et økende antall studier indikerer at forskjellige metaller i svevestøvet kan spille en viktig rolle for å utløse helseeffekter [86]. Det har vært fokusert mest på overgangsmetaller som jern, vanadium, nikkel, krom, kobber og sink, særlig på grunn av deres evne til å forårsake oksidativt stress i biologiske vev. Det er blitt utført studier der effekten av svevestøv med høyt versus lavt metallinnhold er sammenlignet, hvor partikler er samlet inn i områder med og uten stålindustri, eller i forbindelse med midlertidig stenging av smelteverk. Både dyr og cellekulturer er eksponert for slike metallrike partikler og vandige ekstrakter av dem. Vandige ekstrakter av partikler fra et smelteverksområde i USA (Utah Valley), forårsaket mer lungeskade og betennelsesreaksjoner mens fabrikkene var åpne enn da de var stengt pga. streik [87-89].
Studier med svevestøv fra et område med mange smelteverk i Tyskland forårsaket mer allergiske reaksjoner i mus enn svevestøv fra et tilsvarende område, men med mindre industri [90]. Metallrike partikler er også vist å gi effekter i hjertemuskelen og sammentrekninger av blodårer hos forsøksdyr [86, 91]. Studier tyder på at hjertefunksjonen i dyremodeller er påvirket av uorganiske PM-komponenter, og at oksidativt stress er viktig for disse effektene [92]. I hvilken grad effektene observert ved de høye konsentrasjonene som er brukt i disse studiene, er relevante for effekter hos mennesker ved lavere konsentrasjoner over mye lengre tid, er imidlertid usikkert.
Svarte karbonpartikler
Det foreligger bare svært få eksperimentelle studier hvor effekten av PM2,5 sammenlignes med BC/EC, og hvor sammensetningen av partiklene samtidig er karakterisert. Disse få studiene tyder ikke på at BC/EC i seg selv gir noen toksikologiske effekter, men at effektene av PM2,5 heller kan tilskrives ulike organiske forbindelser eller metaller bundet til BC/EC [9].
Byluftpartikler
Oppkonsentrerte byluftpartikler (CAPs) er benyttet i mange studier og kan gi god informasjon om helseeffekter av svevestøv, da de representerer en blanding av partikler som forekommer i omgivelsene. CAPs inkluderer forskjellige størrelsesfraksjoner, men de aller fleste studiene har benyttet finfraksjonen (PM2,5).
Helserelaterte effekter er registrert i hjertekar, nerve, lever og luftveissystemet etter kort og langtids inhalasjonsstudier. Videre er mekanismer for disse effekt ene studert i cellekulturer fra de relevante organene.
Korttidseksponering
Kortidseksponering av laboratoriedyr (friske og følsomme) ved inhalasjon har vist effekter på luftveis-, hjerte- og karsystemet ved konsentrasjoner av CAPs som ligger nær eller noe over nivåer som kan forekomme i byluft [86]. Endringer i hjertefunksjonen, som hjertefrekvens, samt betennelsesreaksjoner i luftveiene, er observert fra ca 200 µg/m3 PM ved 5-10 timers eksponering i 13 dager. Oksidativt stress synes å være sentralt for mange av de akutte effektene indusert av CAPs [92]. Eksponering for CAPs har også vist å øke følsomheten for luftveisinfeksjoner [8]. Økning av koagulasjonsfaktorer i blodet er dessuten påvist i dyreforsøk etter CAPs-eksponering [93].
I en oppsummeringsstudie av RAIAP¨-prosjektet rapporterer Steerenberg og kolleger at trafikkrelaterte svevestøv komponenter (ulike metaller og organiske forbindelser) i byluftpartikler kunne relateres til effekter på allergimarkører [94]. Eksponering for CAPs (~360 µg/m3 i 5 timer) er også vist å gi økt blodtrykk og redusert blodtilførsel til hjertemuskelen hos forsøksdyr [8, 95, 96]. Flere inhalasjonsstudier har også vist at CAPs kan forårsake effekter i sentralnervesystemet (CNS), som betennelsesreaksjoner. Oksidativt stress er foreslått å være involvert i disse effektene, men mekanismen er fortsatt uklar [8].
Medium- og langtidseksponering
Eksponering i perioder fra noen uker til flere måneder er foretatt ved nivåer som også er under 100 µg/m3 PM2,5 [92]. I slike studier er det bl.a. observert betennelsesreaksjoner i luftveiene, endringer i hjertefrekvensen, økt plakkdannelse i blodårer, endringer i hjernens morfologi og funksjon, samt fettlever. Funnene som ble gjort i lever og nervesystemet som følge av subkroniske inhalasjonsstudier i dyr, er foreløpig ikke observert i befolkningsstudier. Videre er det vist i dyreforsøk at inhalasjon av CAPs kan påvirke motstanden mot bakterieinfeksjoner, forsterke immunresponsen og muligens fremme utvikling av allergi [92]. Dette siste poenget kan illustreres med et forsøk hvor følsomme mus (sensibilisert med ovalbumin) ble eksponert for CAPs nær en trafikkert hovedvei i 2 uker. Disse dyrene viste en forsterket immunrespons sammenlignet med dyr som var plassert i større avstand fra hovedveien og de ueksponerte kontrollene [97].
I en studie hvor finfraksjon av CAPs (~ 440 µg/m3) var sammenlignet med ultrafin fraksjon (~ 110 µg/m3) etter eksponering av mus langsmed en hovedvei, var det bare den ultrafine fraksjonen som ga økninger av plakkstørrelsen i blodårene, samt ga mest oksiditativt stress [98]. I en annen studie av CAPs-eksponering i mus (~90 µg/m3 6 timer hver arbeidsdag i 2 uker) er det observert økt koagulering, og det er foreslått at partikler spiller en rolle i aktivering av blodplater [99].
Ved langtidseksponering av genmodifiserte mus med økt følsomhet (apoE/) er det vist effekter av CAPs (PM2,5) ved lave konsentrasjoner (85 µg/m3) etter eksponering over kortere perioder i 6 måneder (Sun et al. 2005). Dette nivået er omregnet til en gjennomsnittsverdi på 15,2 µg/m3 for hele 6 månedersperioden. Videre har langtidseksponering for CAPs i overvektige mus vist at PM-fraksjonen kan øke resistensen mot insulin, noe som er en risikofaktor for utvikling av diabetes. Det er også vist i dyreforsøk at eksponering for byluft kan påvirke reproduksjonsevnen hos begge kjønn, samt påvirke fosterutviklingen [8].
Kontrollerte studier på mennesker
Sammendrag - kontrollerte studier på mennesker
Eksperimentelle studier utført med frivillige personer under kontrollerte betingelser viser at svevestøv kan påvirke luftveier og hjerte-karsystemet. I slike kliniske studier benyttes eksponeringer fra noen minutter til noen timer. Spesielt er dieseleksospartikler (DEP) undersøkt, og effekter på luftveiene er observert med en terskelverdi rundt 300 µg/m3. DEP er også vist å kunne stimulere blodproppdannelse, og gi effekter som kan føre til redusert blodtilførsel til hjertet i samme konsentrasjonsområdet (300-350 µg/m3). DEP synes å kunne forsterke allergiske responser. Eksponering for røyk fra vedfyring i nivåer 240-280 µg/m3 er vist å gi økte betennelsesreaksjoner og oksidativt stress i nedre deler av luftveiene. Metallrike partikler fra industriutslipp synes imidlertid mer potente enn partikler fra andre kilder. Oppkonsentrerte byluftpartikler (CAPs; 150-300 μg/m3) er også vist ved kortvarig eksponering å gi betennelsesreaksjoner i luftveiene og effekter på hjerte- og karsystemet. Foreliggende kliniske forsøk med svarte karbonpartikler som stammer fra dieseleksos eller vedfyring er ikke tilstrekkelige til å si om disse gir kvalitativt forskjellige effekter fra PM2,5. Svarte karbonpartikler synes å være lite toksiske, men heller fungere som bærere av ulike kjemiske forbindelser i PM2,5-fraksjonen.
Eksperimentelle studier utført med frivillige personer i kammer eller på annen måte viser at svevestøv kan påvirke luftveier, blodårer og hjerte. Slike kliniske studier benytter korte eksponeringer fra noen minutter til noen timer. Siden dosene som brukes er lave, er effektene som studeres ofte kun markører for reaksjoner i vev, som kan føre til sykdom.
Eksospartikler
Inhalasjon av dieseleksospartikler (DEP) er vist å gi effekter både i luftveis- og i hjerte-karsystemet hos mennesker [48, 92]. Dessuten er det registrert endringer i hjerneaktivitet hos friske forsøkspersoner etter eksponering for dieseleksos [100]. Eksponering for dieseleksos (108 µg/m3 PM10) i 2 timer ga betennelsesreaksjoner hos friske personer og sammentrekninger i luftveiene både hos både friske og astmatiske personer, uten at det ble påvist symptomer [101]. Ved eksponering av friske personer i en veitunnel i Stockholm med gjennomsnittlige PM2,5 og PM10-konsentrasjoner på henholdsvis 64 og 176 µg/m3, ble det påvist økte betennelsesreaksjoner i luftveiene sammenlignet med personer som oppholdt seg i byluft utenfor tunnelen [102]. Kortidseksponering for PM i konsentrasjoner relevante for byluft er foreslått å føre til mildt oksidativt stress i luftveiene [8].
Andre studier på frivillige, friske forsøkspersoner tyder på at DEP ikke bare kan forsterke allergiske responser, men også kan påvirke immunresponser i retning av aller giske reaksjonsmønstre [103-105]. Hos pasienter med allergi mot husstøvmidd er det vist at eksponering for DEP før eksponering for middallergen, resulterte i kraftigere symptomer, forhøyede histaminverdier og ved mye lavere nivå av allergen, sammenlignet med eksponering for allergen alene [103].
DEP kan også binde pollenallergener og virke som transportører av allergener som bidrar til økt avsetting av allergener i lungene [106]. I en oppsummering av kammerstudier med eksponering for DEP alene ble det funnet betennelsesreaksjoner i luftveiene ved forholdsvis høye konsentrasjoner med en terskeldose rundt 300 μg/m3. I disse studiene synes ikke astmatikere å være mer følsomme enn friske for betennelsesreaksjonene [107].
I tillegg til effekter på luftveissystemet har inhalasjon av DEP i kliniske studier også vist effekter på blod og blodkar. Flere svenske studier utført med personer i inhalasjonskammer, viser at DEP-eksponering kan fremkalle en rekke akutte effekter relaterte til hjerte- og karsykdom, inkludert hemming av faktorer som motvirker blodproppdannelse, og nedsatt utvidelse av blodårene som gir indikasjoner på redusert blod tilførsel til hjertet [108-112]. Dette ble observert hos friske frivillige ved DEP-konsentrasjoner i området 300-350 μg/m3.
Eksponering for bensineksos i svært kort tid (6 minutter x 2) og under maksimal fysisk belastning (sykling) indikerer påvirkning av den fysiske aktiviteten. Forfatterne spekulerer på om dette kan skyldes nedsatt blodtilførsel til musklene [8].
Vedfyringspartikler
Eksponering for røyk fra vedfyring ga i kliniske studier økte nivåer av markører for betennelsesreaksjoner og oksidativt stress i nedre deler av luftveiene i konsentrasjonsområdet 240-80 µg/m3 [113]. Analyser av blod og urin hos deltagerne indikerte sammenheng mellom eksponering for vedfyring og betennelsesreaksjoner, koagulering av blodet og oksidering av fettstoffer. I en dansk studie der frivillige personer ble eksponert for høye doser vedfyringsrøyk, ble det funnet oppregulering i DNA-reparasjonsmolekyler som kunne indikere oksidative DNA-skader [114].
Metallrike industripartikler
Det er utført enkelte kliniske studier på mennesker der man har analysert korrelasjoner mellom svevestøvets innhold av forskjellige metaller og biologiske responser [86]. Det er funnet signifikante korrelasjoner mellom jern i svevestøvet og økte nivåer av betennelsesceller (nøytrofiler) i lungeskyllevæske, og mellom metallene kobber, sink og vanadium og økte nivåer av en koagulasjonsfaktor (fibrinogen) i blodet [89].
Videre er det også utført studier med svevestøv samlet inn både før, i løpet av og i en periode etter en 14 måneders streik ved en stålfabrikk i Utah Valley i USA, som gjorde det mulig å sammenligne effekter av svevestøv med et relativt lavt innhold av metaller med effekter av svevestøv med et høyt innhold av metaller. Det viste seg at lungemakrofager fra personer eksponerte for svevestøv med høyt metallinnhold hadde en nedsatt evne til å ta opp partikler sammenlignet med makrofager eksponert for svevestøv med lavt metallinnhold [115]. Det var flere betennelsesreaksjoner i lungene hos personer som var eksponert for vandig ekstrakt av svevestøv samlet inn mens fabrikkene var åpne enn hos dem som var eksponert for svevestøv samlet inn i samme område mens fabrikkene var stengt [116].
En annen klinisk studie er utført i Tyskland, der potensialet for betennelsesreaksjoner i lunge for svevestøv samlet inn i områder med og uten stålindustri ble sammenlignet [117]. Begge typer svevestøv førte til betennelsesreaksjoner, men svevestøvet fra industriområdet ga sterkere effekter. Disse studiene tyder på at innholdet av metaller kan spille en viktig rolle i toksisiteten til svevestøv, imidlertid er det i disse studiene uklart i hvilken grad de observerte effektene også kan skyldes forskjeller i andre komponenter i svevestøvet.
Svarte karbonpartikler
Mens det i mange befolkningsstudier er foretatt sammenligninger av helseeffekter ved eksponering for svarte karbonpartikler versus PM2,5, er det begrenset hva som er gjort i eksperimentelle studier. I de fleste kontrollerte humane studier er dieseleksos den viktigste kilden for svarte karbonpartikler, selv om også en del studier fokuserer på byluft (PM2,5) og vedforbrenningspartikler som kilder for slike partikler. En svakhet ved de fleste studiene har vært en mangelfull karakterisering av partiklene (innhold av BC, BS eller EC). Konsentrasjoner fra 100 til 350 μg/m3 er benyttet [10].
I en studie av Mills og medarbeidere ble effekten av dieseleksos på hjerte-karsystemet borte ved bruk av partikkelfiltre [118]. Eksponering av friske, frivillige personer i 2 timer for ultrafine karbonpartikler i en miljømessig relevant konsentrasjon (10 μg/m3) viste endringer av overflatemarkører på blodceller, noe som kan representere et veldig tidlig stadium av en betennelsesreaksjon [119]. Videre indikerte studier at ultrafine karbonpartikler (UF EC 50 μg/m3 i 2 timer) kan påvirke blodgjennomstrømmingen (hemmet karutvidelse) hos friske individer [120]. Det ble ikke sett noen effekt på hjerterytmevariabiliteten [8].
Samlet konkluderte WHO [10] med at det til nå ikke er tilstrekkelig eksperimentelle holdepunkter for å avgjøre om PM2,5 og svart karbon (BC) gir kvalitativt forskjellige effekter. De studiene som er gjort tyder imidlertid ikke på at EC (eller BC) er den toksiskekomponenten i PM2,5, men at disse heller fungerer som en universell bærer av ulike kjemiske forbindelser med varierende toksisitet. EC/BC synes imidlertid å kunne opptre som en god markør for de skadelige komponentene i PM2,5.
Byluftpartikler
Konsentrerte utendørspartikler (CAPs, hovedsakelig PM2,5) er studert ved eksponering i kammer. Det ble funnet akutte betennelsesreaksjoner i luftveiene, men det var ingen symptomer på endringer i lungefunksjonen [8, 121]. Endringer i lungefunksjon ble heller ikke påvist hos friske personer eksponert for lave konsentrasjoner (~10 μg/m3) av trafikkpartikler i København. Denne eksponeringen ga imidlertid oksidativt stress og DNA-skader i hjerte-karsystemet, og partikler med størrelse på 57 nm ble ved hjelp av statistiske modeller funnet å gi størst effekt [122]. I studier med friske frivillige ble det observert sammentrekning av blodårer, forandringer i blodet som kan føre til økt levringstendens, samt variabilitet i hjerterytme med CAPs (150-300 μg/m3, PM2,5) i 2 timer [8, 92]. Eksponering for grovfraksjonen av CAPs (PM10-2,5) i 2 timer ga milde hjertekar-/lungesymptomer ved ca 90 μg/m3 (25-160 μg/m3) 20 timer etter eksponeringen. Dette er i samme størrelsesorden som tidligere observert for ”fine CAPs” [123].
Befolkningsstudier
Sammendrag - befolkningsstudier
Mer enn to tusen artikler, med befolkningsundersøkelser fra hele verden, viser at det er en konsistent assosiasjon mellom nivåer av svevestøv (PM) i uteluft, og sykdom og dødelighet i befolkningen. Klarest sammenheng finner man mellom økninger i nivåer av PM10 og PM2,5 og økninger i antall dødsfall og sykehusinnleggelser for luftveis- og hjerte- og karsykdommer. Både konsentrasjonsnivåer i uteluften og varigheten av eksponeringen er viktige faktorer som påvirker helseeffektene av PM. Korttids- og langtidseksponering for PM viser sammenhenger med dødelighet og sykelighet. Sammenhengen mellom PM og helseeffekter ansees som vel etablert i befolkningsstudier. Disse viser lineær doserespons ned mot svært lave konsentrasjonsområder av PM.
Ved korttidseksponering er i den relative risiko for total dødelighet, hjertekar- og respiratorisk dødelighet på henholdsvis 0,6, 0,9 og 1,3 % ved økning på 10 µg/m3 PM10. For PM2,5 synes den relative risikoen ved korttidseksponering høyere, med 0,3-1,2 %, 0,3-1,0 % og 1,0-2,2 % i henholdsvis total, hjertekar- og respiratorisk dødelighet. For langvarig eksponering er risikoen høyere enn for kortvarig, og det er nesten utelukkende fokusert på effekten av PM2,5.
Langvarig eksponering har vist en økt risiko på mellom 4 og 20 % for total dødelighet ved økning av PM2,5 på 10 µg/m. Ved kortvarig eksponering er PM10 og PM2,5 vist å gi økt antall innleggelser på sykehus for luftveis- og hjerte- og karsykdommer. Hos astmatikere er både PM10 og PM2,5 -eksponering vist å være forbundet med økt hyppighet av luftveissymptomer, økt bruk av medisiner og endringer i lungefunksjon. Hos barn er økningen i relativ risiko for sykehusinnleggelser for astma på 1,7 % ved økning av PM10 på 10 µg/m. For innleggelser pga. hjerte- og karsykdommer er det en økning i relativ risiko på 0,6-1,9 % for PM10, og 0,8-3,9 % for PM2,5. Studiene er utført i områder med konsentrasjoner ned mot henholdsvis 20 µg/m3 for PM10 og 68 µg/m for PM2,5, men i de fleste studiene ligger nivåene langt høyere enn dette.
Langvarig eksponering for PM10 og PM2,5 viser sammenheng med økt forekomst av respiratoriske symptomer (kronisk hoste, bronkitt, astma), så vel som redusert lungefunksjon. Befolkningsstudier har også vist sammenheng mellom langvarig PM10 og PM 2,5-eksponering og effekter på hjerte- og karsykdom (koronar hjertesykdom, hjertesvikt). Disse sammenhenger er observert ved årsgjennomsnitt 18-68 µg/m3 for PM10 og 5-10 µg/m3 for PM2,5. Flere studier kan tyde på at PM10 og PM2,5 kan påvirke svangerskapsutfall som for tidlige fødsler og lav fødselsvekt. Dette er imidlertid ikke tilstrekkelig dokumentert.
I tillegg til PM10 og PM2,5, er PM10-2,5 (eller grovfraksjonen), PM 0,1 (ultrafine partikler) og svarte karbonpartikler også brukt som partikkelparametere i befolkningsstudier. Det er imidlertid langt færre studier hvor disse parameterne er brukt. For grovfraksjonen finnes det studier som viser sammenheng med dødelighet og sykelighet etter kortvarig eksponering. For PM 0,1 (ultrafine partikler) og dødelighet er datagrunnlaget alt for tynt til å si noe om en årsakssammenheng. Enkelte studier viser en sammenheng mellom PM0,1-nivåer og innleggelser på sykehus for respiratoriske sykdommer, mens effekter på hjerte-karsystemet er lite dokumentert.
Når det gjelder langtidseksponering for grov og ultrafin fraksjon er det altfor få studier til å kunne trekke noen konklusjon om helseeffekter. Det er vist en sammenheng mellom korttidseksponering for svarte karbonpartikler og dødelighet, og sykehusinnleggelser både for astma og hjerte- og karsykdommer. For langtidseksponering er det også observert en sammenheng med dødelighet og respiratoriske helseutfall, samt lungefunksjonsutvikling. Risikoestimatene for svarte karbonpartikler på dødelighet og sykelighet er høyere enn for PM2,5 og PM10 både ved kortvarig og langvarig eksponering.
PM10 - befolkningsstudier
Sammenhenger mellom eksponering for PM10 og helse har vært undersøkt i en rekke befolkningsstudier. Flere studier av dødelighet samt sykehusinnleggelser består av multisenterstudier eller metaanalyser. De er derfor godt egnet til sammenlignende studier av store befolkningsgrupper, fokusert på flere partikkelparametere (og andre luftforurensningskomponenter), geografiske områder, alder, kjønn, sosioøkonomiske forhold, mottagelige grupper, og ”lagtider” (tid mellom eksponering og måling av effekt).
PM10 og korttidseksponering
Sammendrag - PM10 og korttidseksponering
WHO konkluderte i 2005 med at europeiske studier viste en sammenheng mellom kortvarige endringer i eksponering for svevestøv og dødelighet. For en 10 μg/m3 økning i PM10 ble det funnet en samlet økning i relativ risiko for alle dødsårsaker på 0,6 %, og en økning i risiko for dødsfall ved hjerte- og karsykdom og luftveissykdom på henholdsvis 0,9 % og 1,3 %. Andre store analyser har vist 0,1-0,8 % økning i total dødelighet ved en økning pa 10 μg/m3 PM10. Samlet sett kan studier tyde på at risikoen for økt dødelighet ved kortvarig PM10-eksponering er høyere for barn under ett år enn eldre barn eller voksne.
Befolkningsstudier har også vist at kortvarig eksponering av astmatikere (og spesielt barn) for PM10 synes assosiert med økt hyppighet av symptomer (som hoste og pustevansker), økt bruk av medisiner og endringer i lungefunksjon. Foreliggende studier tyder på at PM10 forsterker responser på allergifremmende stoffer. Eksponering for PM10 er også assosiert med legevaktbesøk/sykehusinnleggelser for respiratoriske sykdommer, som astma, KOLS og respiratoriske infeksjoner. Hos barn er det vist en økning i relativ risiko for sykehusinnleggelser for astma på 1,7 % ved kortvarig økning pa 10 μg/m3 PM10. Multisenterstudier har vist en økning i risiko for innleggelser for hjerte- og karsykdommer i størrelsesorden 0,6-1,9 % ved en kortvarig økt PM10-eksponering.
Gjennomsnittskonsentrasjonene (døgnverdier) i studiene lå mellom 17 og 48 μg/m3 PM10, men de fleste studiene var i området 25-30 µg/m3. Mye av variasjonen i respons både på dødelighet og sykelighet kan skyldes ulike faktorer som sted og årstid, alder (barn og eldre), hvilken dag(er) som måles på i forhold til eksponering, og forekomsten av lunge- eller hjerte- og karsykdom i den studerte befolkningen.
Dødelighet
I en omfattende gjennomgang av studier fra 33 byer og regioner i Europa, (APHEA1, 2; ”Air Pollution on Health: European Approach”) konkluderte WHO2005 [4] med at det er en sammenheng mellom kortvarige endringer i eksponering for svevestøv og dødelighet. For en 10 µg/m3 økning i PM10 ble det funnet en samlet økning i relativ risiko for alle dødsårsaker på 0,6 %, og en økning i risiko for dødsfall ved hjerte- og karsykdom og luftveissykdom på henholdsvis 0,9 % og 1,3 %.
Tilsvarende store studier er også utført i USA, slik som NMMAPS (”The National Morbidity Mortality Air Pollution Study”). Denne studien, som baserte seg på 90 av de største amerikanske byene, viste en økning i risiko på 0,21 % for total dødelighet ved 10 µg/m3 økning i PM10. USEPA 2009 [8] som inkluderer enda flere studier, rapporterer om risikoøkninger fra 0,12 til 0,84 %.
Den tilsynelatende lavere dødeligheten i USA kan skyldes ulikheter i metodologi og analysemåte, og også ulikheter i eksponeringen i USA versus Europa. Variasjonen i risikoestimater kan også skyldes årstid som kan gi ulik partikkelsammensetning. Risikoestimatene er konsistent høyere for respiratorisk og hjerte- og kardødelighet enn total dødelighet, i overensstemmelse med at individer med underliggende lunge- og hjerte- og karsykdom er mest mottakelige for PM10-eksponering.
Alder er en viktig faktor, ved at eldre over 75 år viste høyere risikoestimater enn personer under 75 år (0,47 versus 0,12 % i USA). Hvilke(n) dag(er) før helseeffekten inntrer som kan settes i sammenheng med denne effekten, hadde også betydning for risikoestimatet. Dødeligheten 12 dager etter eksponering viste de høyeste risikoestimatene, men dette varierte med dødsårsaken. Risikoestimatene ble ikke/lite påvirket av kjønn eller rase. Inkludering av andre luftforurensningskomponenter i analysemodellene påvirket heller ikke risikoestimatene for PM10 så mye.
Andre metaanalyser utenom Europa og USA viste sammenlignbare risikoestimater for PM10 og daglig dødelighet [4]. I en metaanalyse av studier i Asia, både tidsserie og «casecrossover» studier, ble det funnet en økt dødelighet på nivå med de amerikanske studiene [124]. I en studie av personer som hadde overlevd sin første hjerteinfarkt var økningen i dødelighet betydelig høyere enn for befolkningen ellers, ca 5 % per 10 µg/m3 økning i PM10. Dette resultatet understreker hvor mye mer utsatt mottagelige personer er for effekter av luftforurensningen. Denne studien inkluderte også svenske individer som var eksponert for omtrent tilsvarende lave nivåer som dem man finner i Norge [125]. KOLS-pasienter har også en betydelig økt risiko for dødsfall etter eksponering for PM10 (ca 5 ganger) sammenlignet med en gruppe som ikke har denne sykdommen. For PM2,5 og NO2 er sammenhengen enda sterkere [126].
Dødelighet hos spedbarn: Mange studier har påvist assosiasjoner mellom eksponering for PM og økt dødelighet hos spedbarn, og spesielt i perioden fram til ett års alder. Det har vært fokusert mest på langtidseksponering fra uker og opp til ett år, men også kortvarig eksponering (0-2 dager) for PM10 kan føre til økt dødelighet både i den tidlige perioden fram til 1 måned etter fødsel (neonatal fase) og også i den påfølgende fasen opp til ett års alder (postneonatal fase).
I den tidlige, neonatale fasen er det foretatt få studier, men i en større studie er det rapportert 1,7 % økning i risiko for total dødelighet ved 10 µg/m3 økning i PM10. I den senere, postneonatale fasen er det foretatt flere studier, med risikoøkninger på 0,6-3,1 % [8]. I en metaanalyse av Lasacana et al [127] angis en risikoøkning på 3,3 % for total dødelighet i den postneonatale fasen ved kortvarig PM10-eksponering. I denne fasen er det enda høyere relativ risiko for å dø av effekter på luftveissystemet, med risikoøkninger fra 16 til 57 % [8]. Samlet sett kan studiene tyde på at risikoen for økt dødelighet ved kortvarig PM10-eksponering er høyere for barn under ett år enn senere i livet.
Luftveissykdommer
Effekten av PM10 og andre størrelsesfraksjoner av partikler er blitt undersøkt i befolkningsstudier, med mange endepunkter relatert til luftveissykdommer både hos barn og voksne (inkludert eldre). Det har vært fokusert spesielt på følsomme grupper som astmatiske barn og voksne med astma, KOLS eller annen lungesykdom.
I disse studiene har en studert alt fra luftveissymptomer (som hoste, pustevansker), økt medisinering, lungefunksjon, betennelsesreaksjoner, forsterkning av allergiske reaksjoner, mottagelighet for infeksjoner, og sist men ikke minst besøk på legekontor, legevakt og sykehusinnleggelser for luftveissykdommer. Mange av studiene har forskjellige metodeopplegg, enten det gjelder studiedesign, endepunkter og målemetoder, samt tid mellom eksponering og måling av effekter.
Eksponering av astmatikere for kortvarig økte PM10-nivåer synes assosiert med økt hyppighet av symptomer og økt bruk av medisiner, selv om effektene i mindre grad er signifikante enn for PM2,5 [8]. Slike assosiasjoner er spesielt hos astmatiske barn. Hos voksne astmatikere er sammenhengene mindre konsistente, og hos friske personer er det ikke påvist noen sammenheng. Det foreligger relativt få befolkningsstudier om hvorvidt eksponering for svevestøv kan forsterke allergisk sykdom. De foreliggende studiene tyder imidlertid på at PM10 (og PM2,5) kan forsterke responser på allergifremkallende stoffer [8]. USEPA2009 har også konkludert med at PM10 er assosiert med endringer i lungefunksjon, men at det er vanskelig å adskille disse effektene fra andre luftforurensningskomponenter.
Økt eksponering for PM10 er forbundet med legevaktbesøk/sykehusinnleggelser for respiratoriske sykdommer, som astma, KOLS og respiratoriske infeksjoner [4, 8]. I 2006 publiserte Romeo og medarbeidere en metaanalyse av befolkningsstudier (tidsserier, panelstudier) på sammenhengen mellom kortvarig PM10-eksponering og astmatiske responser hos barn. De fant en økning i relativ risiko for sykehusinnleggelser (1,7 %), episoder med piping i brystet (6,3 %) og hoste (2,6 %), økt bruk av astmamedisiner (3,3 %) ved en økning på 10 µg/m3 PM10. Lungefunksjonen ble også redusert [128]. Senere ble en tilsvarende metaanalyse publisert, med et utvidet datagrunnlag og bare astmatiske barn. Denne viste en økning i relativ risiko for astmatiske symptomer (piping 2,8 %) og hoste (1,2 % ved en økning på 10 µg/m3 PM10. Lungefunksjonen ble også redusert [129].
En metaanalyse av tidsseriestudier fra Canada tydet på mest konsistente sammenhenger mellom luftforurensninger og akutt sykehusbesøk for respiratoriske og hjerte-kareffekter hos voksne. PM10 så ut til å ha en sterk sammenheng med sykehusbesøk for astma i sommerhalvåret [130]. Det foreligger få befolkningsstudier av helseeffekter ved svevestøvseksponering i Norge. Det er gjennomført to tidsrekkestudier i Drammen for periodene 1995-1997 og 1995-2000. I begge studiene fant man en økt risiko for sykehusinnleggelser for luftveissykdommer som følge av økte konsentrasjoner av PM10 og andre luftforurensningskomponenter [131, 132].
Effekter på hjerte- og karsystemet
I befolkningsstudier er sammenhengen mellom eksponering for PM10 og sykehusinnleggelser studert for hjerte- og karlidelser av alle årsaker, så vel som en lang rekke spesifikke undergrupper av hjerte- og karsykdommer, inkludert akutt hjerteinfarkt, hjertesvikt, rytmeforstyrrelser og hjerneslag.
Innleggelser for hjerte- og karsykdom. Basert på den store omfattende amerikanske ”NMMAPS-studien” og andre studier har USEPA oppsummert at den samlete økning i risiko for innleggelser for hjerte- og karsykdommer lå i størrelsesorden 0,6-1,7 % ved en kortvarig økning på 10 µg/m3 PM10, og spesielt blant eldre. Senere store studier har også vist risikoøkninger i samme størrelsesorden, med 0,7 % i den europeiske "APHEA2-studien", og 0,9 %, 1,9 % og 0,9 % i andre store studier fra Europa og USA ved en kortvarig økning på på 10 µg/m3 PM10. Flere av disse studiene inkluderer bare eldre over 65 år, og angir ”lagtider” i forhold til tid for eksponering på 12 dager. I studiene har gjennomsnittskonsentrasjonene ligget fra 17 til 48 µg/m3 PM10, med en hovedvekt av nivåer rundt 25-30 µg/m3 PM10 [8].
Tilsvarende har en undersøkt risikoestimatene for PM10 og ulike typer hjerte- og karsykdommer. For innleggelser for hjertesykdommer (hjerte- og karsykdommer minus sirkulasjonssykdommer) er tallmaterialet begrenset, men det er rapportert risikoøkninger på 1,5 % og 21 % ved en økning på 10 µg/m3 PM10. Muligens er risikoestimater for hjertesykdommer noe større enn for hjerte- og karsykdommer. En viktig undergruppe av hjertesykdom er de som skyldes manglende oksygentilførsel til hjertet (også kalt koronar hjertesykdom, og som bl.a. inkluderer akutt hjerteinfarkt og angina pectoris). Store studier har vist risikoestimater på 0,8 % (APHEA2-studien), og 2,4 % (8-byer, Frankrike), 2,3 % (SOPHIA-studien, ikke-signifikant), 0,8 % (Sydney, Australia) ved en økning på 10 µg/m3 PM10 [8].
Samlet sett understøtter de nye studiene tidligere studier som tyder på en sammenheng mellom kortvarig PM10-eksponering og sykehusinnleggelser/legevaktbesøk for denne sykdomsgruppen. Tilsvarende oppsummerer USEPA [8] at det er en sammenheng mellom kortvarig eksponering for PM10 og sykehusinnleggelser/legevaktbesøk for hjertesvikt, med risikoøkninger fra 0,7 % til 4,6 % ved en økning på 10 µg/m3 PM10. I 2012 er det foretatt en stor metaanalyse (basert på 117 studier) av sammenhengen mellom kortvarig eksponering for ulike luftforurensningskomponenter og effekter på hjerteinfarkt. Samlet sett var økningen i risiko for hjerteinfarkt på 0,6 % ved en økning av PM10 på 10 µg/m3 [133].
Det er også blitt undersøkt om PM10 og andre PM-fraksjoner er forbundet med innleggelser for sykdommer som gir redusert blodforsyning til hjernen, (hjerneslag), men en rekke tidsseriestudier har vist inkonsistente resultater. Selv om enkelte studier finner positive, men ikke-signifikante økninger i relativ risiko, rapporterer flere studier ingen eller negative assosiasjoner med eksponering for PM10 [8].
Spesifikke hjerte-kareffekter. I tillegg til studiene av sykehusinnleggelser og PM10-eksponering, har også andre effekter i hjerte-karsystemet som forstyrrelser av hjerterytme (endret variabilitet, arytmier) manglende oksygentilførsel til hjertet, endringer i blodkarsystemet, økt systemisk betennelse, og endringer i blodplater og koagulasjonsfaktorer vært studert for å belyse sammenheng med kortvarig eksponering for PM10 (og andre PM-fraksjoner). For flere av disse endepunktene er det ikke foretatt like store sammenlignende analyser som for sykehusinnleggelser/legevaktbesøk, og det er derfor oftere vanskeligere å trekke konklusjoner. Redusert hjerterytmevariabilitet (HRV) er vist å være forbundet med økt sykelighet/dødelighet.
Mange befolkningsstudier har vist at PM10-eksponering er assosiert med redusert HRV [8]. PM10-eksponering synes imidlertid ikke å være assosiert med forekomsten av hjerterytmeforstyrrelser registrert på ulike måter [8]. Effekten av PM på oksygentilførselen til hjertet er også blitt studert, men ingen positive studier er rapportert for PM10. Dette skyldes muligens fokusering på effekter av PM 2,5. Effekt av PM10 på redusert utvidelse av perifere blodkar (vasodilatasjon) er blitt studert bare i begrenset grad i befolkningsstudier. Det er derfor ikke mulig å si om dette er av betydning [8]. Det er også blitt studert hvordan PM-eksponering er assosiert med endringer i blodtrykket (diastolisk/systolisk) i befolkningsstudier. Selv om to enkeltstudier tyder på en assosiasjon mellom PM10-eksponering og økning i blodtrykk, er datagrunnlaget for tynt til å angi en sammenheng.
I flere befolkningsstudier er det studert om kortvarige endringer i PM-eksponering er assosiert med endringer i markører for betennelsesreaksjoner. I en stor multisenterstudie ble det undersøkt hvordan PM10, PM2,5 og partikkelantall og ulike gasser var assosiert med et stressprotein fra hjerte (CRP; cardiac reactive protein). Ingen av partikkelkomponentene og heller ikke PM10 var assosiert med endringer i CRP [134].
Dette støttes av to andre studier, mens to studier var positive. Samlet sett tilsier de foreliggende studiene ingen konsistent sammenheng mellom PM10 (eller andre PM-komponenter) og CRP [8]. For andre betennelsesmarkører (som IL-6) er det for få studier til å trekke noen slutninger, selv om det i en større studie rapporteres at PM10 (og PM2,5) er assosiert med plasmanivåer av denne markøren [135].
Det er også blitt undersøkt hvordan PM (inkludert PM10) er forbundet med endringer i koagulasjonsfaktorer i blodet (som von Willebrandts faktor og fibrinogen). I et begrenset antall studier er det vist en sammenheng mellom kortvarig PM10-eksponering og nivåer av von Willebrandts faktor i plasma både hos friske personer og diabetikere [8]. Sammenhengen mellom fibrinogen og PM10 er derimot ikke konsistent, med både positive og negative studier. Flere andre markører er også blitt studert, men i for få studier [8].
Effekter på sentralnervesystemet
Det har i det senere tid vært fokusert på om svevestøv (PM) kan gi nevrologiske endringer. I USEPA2009 [8] rapporteres det imidlertid bare om én befolkningsstudie som ser på sammenhengen mellom PM (PM10) og effekter på sentralnervesystemet. I denne studien av Chen og Schwartz [136] var det en tilsynelatende sammenheng mellom resultatet av nevrologiske tester og kortvarige endringer i PM10-nivåer etter justering for alder og kjønn. Etter justering for rase/etnisitet og sosioøkonomisk status forsvant imidlertid effekten.
PM10 og langtidseksponering
Sammendrag - PM10 og langtidseksponering
Sammenhengen mellom langvarig eksponering (over år) for PM10 og effekter på dødelighet, sykelighet pga. luftveis- og hjerte- og karsykdommer og på svangerskapsutfall er blitt undersøkt i et begrenset antall befolkningsstudier. For dødelighet foreligger det studier av spedbarn som tyder på en sammenheng med eksponering for PM10.
Langvarig eksponering for økte PM10-nivåer har sammenheng med økt forekomst av respiratoriske symptomer (kronisk hoste, bronkitt, astma), så vel som redusert lungefunksjon. Slike sammenhenger er vist ved årsgjennomsnitt fra 18 til 68 µg/m3 PM10. Reduksjon av PM 10-nivåer synes å føre til reduksjon i både respiratoriske symptomer og sykdommer hos barn.
Langvarig eksponering for PM10 gir redusert lungefunksjonsutvikling hos barn. Denne effekten synes å vare i alle fall fram til 18-årsalderen. Flytting til områder med lavere PM10 kan forbedre lungefunksjonen. Befolkningsstudier har også vist sammenheng mellom langvarig PM10-eksponering og hjertesykdom. Det synes å forekomme ved konsentrasjoner på 20-30 µg/m3 PM10.
Effekter av PM10 på hjerneslag er mindre studert. Mange studier kan tyde på at PM10 påvirker svangerskapsutfall, som for tidlig fødsler og lav fødselsvekt. Dette er ikke tilstrekkelig dokumentert.
Det er i de senere år gjort en del befolkningsstudier som belyser sammenhengen mellom langvarige eksponering for PM10 og effekter på dødelighet, forekomst av luftveis- og hjerte- og karsykdommer og kreft, samt effekter på reproduksjon, og på sentralnervesystemet.
Dødelighet
Effekter av langtidseksponering (over år) av svevestøv er blitt studert i prospektive kohortstudier. I amerikanske studier (”Six Cities Study”, ”American Cancer Study, ACS”, ”AHSMOG Study”) og en utvidet oppfølgingsstudie av ACS-studien, samt en studie fra Nederland ble det rapportert [4, 8, 137-141] om en sammenheng mellom eksponering for PM2,5 og dødelighet. Det ble imidlertid ikke funnet noen sammenheng med eksponering for PM10. Noe av problemet kan ha vært dårligere eksponeringskarakterisering for PM10 enn for PM2,5. Dette har ført til at det ved senere studier og re-analyser hovedsakelig har vært fokusert på sammenhengen mellom PM2,5 og dødelighet, og ikke inkludert analyser av PM10.
I en re-analyse av ASHMOG-studien beskrives imidlertid en økt risiko på 22 % for koronar hjerte- og kardødelighet hos kvinner ved en økning i PM10 på 10 µg/m3. I en tysk kohort med individer som har kronisk obstruktiv lungesykdom (KOLS), beskrives en økning i relativ risiko for hjerte- og kardødelighet på 52 % ved en økning på 10 µg/m3 PM10 [8]. Totalt sett har studiene med PM10 på dødelighet begrenset verdi sammenlignet med PM 2,5.
Også for dødelighet av lungekreft er det nesten utelukkende fokusert på langvarig eksponering for PM2,5. I ”Six Cities Study”og ”ASHMOG-studien ble det imidlertid funnet at langvarig eksponering for PM10 var forbundet med økt dødelighet for kreftutvikling, men effektene var ikke signifikante. Norske studier har rapportert assosiasjoner mellom langvarig PM10-eksponering og dødelighet for lungekreft hos kvinner, men med lavere risikoestimater, enn for PM2,5 [142]. I denne studien var det usikkerhet om sammenhengene kunne skyldes sosioøkonomiske forhold.
Økt dødelighet hos spedbarn. Det er vist i befolkningsstudier at langvarig eksponering for PM10 er forbundet med økt dødelighet hos spedbarn, både i den tidlige fasen fram til én måned (neonatal fase), og i den senere fasen fram til ett år (postneonatal fase). Eksponeringsperioden varierer i disse studiene. I enkelte studier innbefatter dette perioden fra fødsel til død, mens i andre studier er det en definert eksponeringsperiode (uker, måneder, og opptil ett år) [8]. I den tidlige fasen foreligger bare svært få studier.
I en stor amerikansk studie av eksponering i den neonatale fasen, hvor det er justert for mange mulige forstyrrende faktorer som fødselsvekt, kjønn, geografisk område, etnisitet, alder og ikke minst røykevaner, synes dødeligheten å øke med 13 % ved en økning av PM10 på 10 µg/m3 [8, 143]. Et par studier viste imidlertid ingen assosiasjon. I en metaanalyse av studier i den senere, postneonatale fasen er det ved langvarig eksponering vist en risiko for økt dødelighet på 4,8 % for total dødelighet og 21,6 % for respiratorisk dødelighet ved en økning på 10 µg/m3 [127]. USEPA2009 [8] konluderer med at det finnes sterkest sammenhenger i den sene postneonatale fasen og spesielt for respiratorisk dødelighet, selv om dette ikke var konsistent i alle studier.
Luftveissykdommer
Sammenhengen mellom langvarig eksponering for PM10 (og andre PM-fraksjoner) og respiratoriske symptomer, lungefunksjon samt sykdomsutvikling, er blitt studert i befolkningsstudier. I disse studiene er det fokusert på barn.
Respiratoriske symptomer. Enkelte tidlige studier viste sammenheng mellom langvarig eksponering for PM10 og symptomer på bronkitt [144]. I flere av disse studiene var det usikkerhet om i hvilken grad analysene ble forstyrret av andre luftforurensningskomponenter. En reduksjon av PM10-nivåene i flere områder i Sveits synes å ha ført til en reduksjon i både respiratoriske symptomer og sykdommer hos barn. I perioden fra 1993 (maks verdi 46 µg/m3) til 2000 ble PM10-nivåene gjennomsnittlig redusert med 10 µg/m3. Dette var assosiert med en redusert forekomst av kronisk hoste, bronkitt og forkjølelse (20-35 % reduksjon). Reduksjonen i effekt synes proporsjonal med reduksjon i PM10 [8, 145]. I en svensk studie av førskolebarn (0-4 år) ble det funnet en økning i risiko for piping i brystet (wheezing) på 28 % ved en økning på 10 µg/m3 PM [146]. Færre studier er gjort med voksne, men en studie fra Sveits viste at reduksjon i PM10-og at overflateareal kan være eksponeringen hos voksne var forbundet med reduksjon i ulike respiratoriske symptomer [147].
Lungefunksjon. Flere kohortstudier synes å vise sammenhenger mellom langvarig eksponering for PM10 og endringer i lungefunksjonsutvikling. En stor kohortstudie fra California (CHS) har vist sammenheng mellom PM10, foruten andre luftforurensningskomponenter, og redusert lungefunksjonsutvikling hos barn [148]. I en oppfølgingsstudie fant Gauderman og medarbeidere en vedvarende senkning i lungefunksjonsutviklingen, som var av klinisk betydning, selv ved 18årsalderen. Interessant nok synes det å være en lineær sammenheng mellom PM10-konsentrasjoner og lungefunksjon helt ned mot 18 og opp til 68 µg/m3. Det var imidlertid en tilsvarende korrelasjon med andre luftforurensningskomponenter som PM2,5, svarte karbonpartikler (BC) og NO2, men lite eller ingen sammenheng med ozon [149].
USEPA2009 [8] rapporterer om flere lignende studier som understøtter sammenhengen mellom PM10-eksponering og lungefunksjonsutvikling hos barn. En sentral studie av Avol og medarbeidere [150] viste at barn som flyttet til et område med høye PM10-konsentrasjoner hadde en redusert vekst i lungefunksjon sammenlignet med barn som flyttet til områder med lave nivåer av PM10.
Studier av Kunzli tyder på at PM10 ikke bare forsterker allerede eksisterende astma, men også bidrar til selve utviklingen av sykdommen [151]. Sammenhengen mellom eksponering for luftforurensning og forekomst av astma ansees fremdeles som uavklart. Langt færre studier har fokusert på mulige sammenhenger mellom eksponering for PM og allergi. Enkelte av disse studiene har funnet at eksponering med PM10 er assosiert med ulike allergiske reaksjoner i øvre luftveier (som høysnue), mens i andre studier er det ikke funnet effekt [8].
Befolkningsstudier kan tyde på at langvarig partikkeleksponering er forbundet med økt forekomst av luftveisinfeksjoner. Dette synes mindre undersøkt for PM10 enn PM2,5, men i en stor studie er det vist at reduksjon i PM10-nivåer ga redusert forekomst av forkjølelse og betennelse i luftveiene [145].
Totalt sett er holdepunktene for årsakssammenhenger mellom PM10 og effekter på respiratoriske symptomer, lungefunksjonsutvikling og respiratorisk sykdom blitt styrket. Dette inkluderer studier med individuell eksponering via ulike metoder, ulike forsøksdesign, data fra ulike forskningsgrupper og ulike land. Det har vært fokusert mest på barn, men det er også rapportert sammenhenger med PM10 i enkelte studier med voksne [8].
Hjerte- og karsykdommer
Befolkningsstudier har blitt brukt til å studere mulige sammenhenger mellom langvarig eksponering for PM10 (og andre PM-fraksjoner) og forekomsten av hjerte- og karsykdom og relaterte effekter.
Hjerte- og karsykdom. Forskjellige studier har delvis fokusert på hjerte- og karsykdommer samlet eller på ulike typer som koronar hjertesykdom, inkludert hjerteinfarkt og angina pectoris, hjertesvikt og karsykdommer som leder til hjerneslag. I en studie fra USA ble det funnet 10 % økning i risikoen for koronar hjertesykdom ved en økning på 10 µg/m3 PM10 (årlig gjennomsnitt) [152].
To svenske studier av Rosenlund og medarbeidere viste inkonsistente resultater, men den siste studien rapporterte om 4 % økning i risikoen for hjerteinfarkt ved økning av PM10 på 5 µg/m3 [153-154]. I en større studie fra USA var en økning på 10 µg/m3 PM10 (årlig gjennomsnitt) assosiert med en økning på 17 % og 11 % for henholdsvis hjerteinfarkt og påfølgende hjertesvikt [155]. De årlige gjennomsnittsnivåene for PM10 i begge de amerikanske studiene og også i en positivt britisk studie [156] lå rundt 20-30 µg/m3 PM10, mens i den svenske studien var det mye lavere nivåer. Sammenhengen med hjerneslag og PM-eksponering er mindre studert. Det foreligger bare én studie for PM10, men den antyder en risikoøkning i størrelsesorden 5-15 % ved en økning på 10 µg/m3 PM10 [156].
Hjerte-kareffekter. Sammenhengen mellom PM10 (og annen PM) er blitt undersøkt for ulike hjerte-karparametere, men i mindre grad enn for forekomst av sykdom. Enkelte studier har sett på sammenhengen mellom PM10-nivåer og utvikling av aterosklerose, antall hvite blodceller og systemisk betennelse, men med lite konkluderende resultater [8].
Effekter på fosterutvikling
Det er en del holdepunkter for at svevestøv og annen luftforurensning kan påvirke fosterutviklingen ved eksponering av mødre under svangerskapet. Ulike endepunkter som lav fødselsvekt, for tidlig fødsel og fødselsvekt korrigert for fødselstidspunkt har vært studert. Det har også vært fokusert på om PM10 og andre PM-fraksjoner kan gi misdannelser. Viktige spørsmål er om det er noen spesielt sensitive perioder under svangerskapet, og om i hvilken grad en kan skille effekten av PM10 fra effekt av PM2,5 og andre luftforurensningskomponenter.
Flesteparten av de foreliggende studiene kan tyde på en sammenheng mellom PM10 og lav fødselsvekt, men enkelte av studiene er enten negative eller gir ikke signifikante effekter. Det kan synes som at alle studiene i USA er positive, mens studier fra andre kontinenter er mindre konsistente. Reduksjonen i fødselsvekt synes forholdsvis liten. Effekten synes hovedsakelig å registreres ved eksponering i siste trimester [8]. Det er færre studier av effekter av PM10 på for tidlig fødsel. De fleste av disse studiene synes imidlertid å vise en sammenheng mellom eksponering og effekt. Hvilken periode i svangerskapet som gir effekter varierer i disse studiene, og synes mindre klart enn for effekter på fødselsvekt [8]. Sammenhengen mellom PM10 og misdannelser er mye mindre studert, og viser både positive og negative resultater. [8]. De gjennomsnittlige årsnivåene av PM10 varierte i de positive studiene på ulike svangerskapsutfall, fra nivåer rundt 13 µg/m3 opp mot 50-60 µg/m3 PM10. Nivåene i de fleste studiene ligger rundt 20-40 µg/m3 PM [8].
Det er også kommet noen nye samlende studier som belyser effekten av PM på svangerskapsutfall. Bosetti og medarbeidere [157] oppsummerte 30 befolkningsstudier hvor eksponering for PM10 og/eller PM2,5 er studert. Selv om over halvparten av studiene viste positive sammenhenger, er det fremdeles ikke tilstrekkelig bevis for at eksponering for PM10 (og PM2,5) er forbundet med for lav fødselsvekt og/eller for tidlig fødsel. Flere studier er derfor påkrevet, og spesielt for misdannelser.
De observerte forskjellene kan muligens tilskrives ulik metodedesign og ulik justering for forstyrrende faktorer. I et større internasjonalt prosjekt som involverte 14 forskningsgrupper fra mange land og hvor det delvis ble brukt standardisert metodikk, var det fremdeles store ulikheter i beregnet risiko for effekt av PM10 på fødselsvekt. Omtrent halvparten av studiene viste positive sammenhenger [158]. Dette viser at variasjonen i resultater antagelig ikke skyldes bruk av ulike statistiske metoder eller forsøksdesign. En mulighet er imidlertid at de ulike resultater kan tilskrives forskjellig kjemisk sammensetning av PM10 og PM2,5 i ulike lokaliteter og studier.
PM2,5 (fine partikler) - befolkningssstudier
PM2,5 og korttidseksponering
Sammendrag - PM2,5 og korttidseksponering
I befolkningsstudier er det vist positive assosiasjoner mellom kortvarig PM2,5-eksponering og dødelighet og sykelighet. Store multisenterstudier viser en økning i relativ risiko på 0,29-1,21 % økning for total dødelighet, 0,3-1,03 % for hjerte- og kardødelighet og 1,01-2,2 % for respiratorisk dødelighet per 10 µg/m3 økning i PM2,5. Den relative risikoen synes størst i den varme delen av året. Alder er også av stor betydning, men mye større risiko for personer over 75 år. Analysene er robuste siden flere typer studiedesign og analysemetoder er brukt. Effekten av PM2,5 er justert for nærvær av andre partikkelkomponenter og gasser.
Kortvarige økninger i eksponering for PM2,5 er assosiert med økte luftveissymptomer (hoste, pustevansker) og økt bruk av medisiner, lungefunksjonsendringer, forsterking av allergiske responser og økning i antall legevaktbesøk/innleggelser på sykehus, med noe sterkere effekter for PM2,5 enn PM10. Lungefunksjonsendringer er best demonstrert hos astmatiske barn. Risikoestimatene for sykehusinnleggelser pga. luftveissykdommer ligger på 14 % økning ved 10 µg/m3 økning i PM2,5 i konsentrasjonsområder mellom 6 og 22 µg/m3.
Multisenterstudier av sammenhengen mellom PM2,5-eksponering og sykehusinnleggelser for hjerte- og karsykdommer synes å vise noe høyere risikoestimater enn for PM10, med økning i risiko fra 0,8 % til 3,9 % ved 10 µg/m3 økning i PM2,5 i geografiske områder med gjennomsnittsverdier mellom 8 og 30 µg/m3, og med mange verdier rundt eller under 18 µg/m3. Risikoen synes tilsynelatende noe høyere i Europa og Australia enn i USA. Positive assosiasjoner er videre vist for sykehusinnleggelser pga. ulike typer hjertesykdommer, som hjerteinfarkt og hjertesvikt. Det er også vist positive assosiasjoner med ulike hjerte-kareffekter, som redusert hjerterytmevariabilitet, redusert oksygentilførsel til hjertet og redusert dilatasjon av perifere blodkar. Samlet sett syns det å være overbevisende data for sammenhengen mellom kortvarig PM2,5-eksponering og dødelighet samt sykelighet i luftveis- og hjerte- og karsystemet.
Dødelighet
I tidligere befolkningsstudier ble helseeffekter (inkludert dødelighet) ofte relatert til konsentrasjonen av svarte karbonpartikler (sot) og ikke til PM2,5. I en oppsummering av studier fra Europa rapporterte WHO2005 [4] at det ikke forelå tilstrekkelig data til å foreta noen metaanalyse av sammenhengen mellom korttidseksponering for PM2,5 og dødelighet. Studier fra USA og Canada viste imidlertid positive sammenhenger mellom PM2,5 og total hjertekar- og respiratorisk dødelighet, selv om spredningen i datamaterialet var stort og til dels ikke viste signifikante sammenhenger [4].
I USEPA-rapporten fra 2009 [8] oppsummeres både eldre og nyere multisenterstudier fra USA og Canada hvor sammenhengen mellom PM2,5 og dødelighet er studert. Disse studiene viser en økning i relativ risiko på 0,29-1,21 % i total dødelighet ved 10 µg/m3 økning i PM2,5. For hjerte- og kardødelighet var økningen på 0,3-1,03 %. Den relative økningen av dødelighet for luftveissykdommer var imidlertid konsistent høyere med en relativ økning i risiko på 1,01-2,2 %. I alle disse studiene var effektene størst 1 til 2 dager etter eksponering. Videre var den relative risikoen størst i den varme delen av året, fortrinnsvis om våren.
I multisenterstudien av Zanobetti og Schwarz [159] ble det funnet en økning i risiko på 2,57 % om våren mot 0,25 til 0,95 % for andre årstider. Alder synes også å være av stor betydning for sammenhengen mellom PM2,5 og dødelighet. I en multisenterstudie av Franklin og medarbeidere [160] var risikoestimatet for PM2,5 høyest for personer over 75 år. Økningen i relativ risiko var ganske lik for begge kjønn, selv om kvinner i enkeltstudier synes å være litt mer følsomme [8, 160, 161]. Et viktig spørsmål er hvordan risikoestimatene er i områder med høye og lave konsentrasjoner.
I multisenterstudien til Franklin og medarbeidere [160] synes risikoestimatet ved økning i PM2,5 å være like høyt under som over en gjennomsnittskonsentrasjon på 15 µg/m3, noe som ikke tydet på en terskel ved dette nivået. En avgjørende innvending mot mange studier kan være at samme analysemetoder/design (tidsseriestudier) stort sett er brukt, med muligheter for gjennomgående feil. Tidsserieanalyser er imidlertid blitt sammenlignet med andre analysemetoder (”casecrossover”) uten at dette påvirket størrelsen på risikoestimatene vesentlig, noe som støtter at funnene er reelle og ikke skyldes svakheter ved den enkelte metode [8, 160, 162].
En nylig studie fra Oslo, hvor en «casecrossover»-metode ble benyttet, viste en 2,8 % økning i dødeligheten (spesielt hjerte-kar) med en 10 µg/m3 økning av PM2,5. Sammenhengen var spesielt tydelig hos personer over 50 år [163]. Andre luftforurensningskomponenter som gasser synes i liten grad å forstyrre risikoestimatene for PM2,5. Nyere studier bekrefter mye av funnene over.
Dødelighet på grunn av hjerte- og karsykdom var assosiert med økninger i PM2,5 i en amerikansk studie. Resultatet var påvirket av sesong, med svakere evidens for sammenhenger i den kalde årstiden [164]. Signifikante sammenhenger ble funnet for 0 til 1 dag etter økning i PM2,5. Tilsvarende sesongvariasjon ble observert i en annen studie hvor PM2,5 var assosiert med dødelighet både på grunn av hjertekar- og lungesykdom [165]. Dessuten syntes sammensetningen av PM2,5 å påvirke sammenhengene i begge studiene. Dette ble bekreftet i en europeisk studie der både mineral og støvpartikler samt sulfat i tillegg til trafikkparametere var assosiert med økt dødelighet [166].
Luftveissykdommer og symptomer
Befolkningsstudier har vist assosiasjoner mellom kortvarig eksponering for PM2,5 og luftveissymptomer, lungefunksjonsendringer, forsterking av allergiske responser utløst av allergener, så vel som antall legevaktbesøk/innleggelser på sykehus, med noe sterkere effekter for PM2,5 enn for PM10 [8, 167].
Økte symptomer (hoste, pustevansker etc) og økt bruk av medisiner som en følge av PM-2,5-eksponering er vist i studier på astmatiske barn. Hos voksne astmatikere er sammenhengene mindre konsistente, og hos friske personer er det ikke observert noen sammenheng [8, 167]. Sammenhengen mellom PM2,5 -eksponering og reduksjoner i lungefunksjon varierte noe, men i majoriteten av studiene var det en sammenheng hos astmatiske barn. Videre synes PM2,5 å forsterke allergiske responser på allergener. Det er blitt vist i befolknings studier at PM2,5 er assosiert med økt frigjøring av markører for betennelse i lungene, noe som understøtter tilsvarende funn med PM2,5 i dyrestudier [8, 167]. Det er også funnet konsistente sammenhenger mellom PM2,5-eksponering og hyppigheten av legevaktbesøk og sykehusinnleggelser. De fleste risikoestimatene ligger på 14 % økning ved 10 µg/m3 økning i PM2,5, og ble basert på observasjoner i områder med PM2,5-konsentrasjoner mellom 6 og 22 µg/m3.
Hjerte- og karsykdommer og relaterte effekter
Hjerte- og karsykdommer. Som tidligere beskrevet er det funnet en sammenheng mellom PM10-eksponering og sykehusinnleggelser for hjerte- og karsykdommer. Et viktig spørsmål er i hvor stor grad denne effekten kan tilskrives forekomsten av fine partikler (PM2,5). En samlet analyse av multisenterstudier som har undersøkt sammenhengen mellom PM2,5-eksponering og totalforekomst av hjerte- og karsykdommer synes å vise noe høyere risikoestimater for PM2,5 enn for PM10, noe som tilsier at PM10-effekten i stor grad kan skyldes nærvær av PM2,5. Risikoestimatene varierer noe, med 0,8 % økning i risiko i en amerikansk studie, 1,9 % i en fransk studie (mot 1,1 % for PM10), 3,9 % (mot 0,9 % for PM10) i en annen amerikansk studie og 1,8 % (mot 0,3 % kan tyde på noe større risiko for sykehusinnleggelser for hjerte- og karsykdom i Europa og Australia enn i USA. I disse studiene har middelverdien for PM2,5 (døgnverdier) ligget i området mellom 8 og 30 µg/m3, og med nesten alle verdiene under 18 µg/m3.
Som for PM10 har assosiasjonen mellom eksponering for PM2,5 og innleggelser for ulike typer hjerte- og karsykdom blitt undersøkt, og for PM2,5 spesielt i perioden etter 2004. For hjertesykdommer samlet (eksklusive karsykdommer) foreligger positive assosiasjoner med kortvarig eksponering for PM2,5 med økning fra 1,9 til 2,4 %. Ved sviktende oksygentilførsel til hjertet indikerer flere store studier fra ulike steder i verden en assosiasjon med PM2,5, med risikoøkninger på 0,4 %, 4,5 %, 2,4 %, 2,6 % og 4,8 % i de ulike studiene ved 10 µg/m3 økning i PM2,5 [8, 167]. Resultatene synes mye klarere enn for PM10.
For PM2,5 og sykehusinnleggelser for hjertesvikt er det også vist assosiasjoner. Risikoøkningen for PM 2,5 synes høyere enn for PM10, men også med større spredning, fra 1,3 til 7,4 %. For innleggelser for rytmeforstyrrelser er det ikke vist noen konsistente assosiasjoner med PM2,5 [8, 167]. Studiene som foreligger viser heller ingen konsistente positive assosiasjoner mellom PM2,5 og sykdommer som gir redusert blodforsyning til hjernen, selv om det er en noe sterkere tendens enn for PM10. I en kanadisk studie ble det funnet en sammenheng mellom besøk på akuttmottak for migrene og hodepine, og eksponering for PM2,5, mens tilvarende sammenheng ikke ble funnet i en amerikansk studie [168, 169].
Markører for hjerte- og kareffekter. Som for PM10 synes PM-2,5-eksponering å være assosiert med forskjellige hjerte- og karmarkører. For hjerterytmeforstyrrelser kan det synes som det er en sammenheng, men dette avhenge av målemetoden [8, 167]. Eldre personer med hjerte- og karsykdom ser ut til å være spesielt utsatt for reduksjoner i ST-segmentet av et elektrokardiogram etter eksponering for PM2,5. Det var ingen sammenheng med partikkeltall, men en sammenheng med «svart karbon» [170]. PM2,5 ser ut til å kunne påvirke oksygentilførselen til hjertet samt redusere dilatasjon av perifere blodkar [8, 167]. Med hensyn til endringer i blodtrykket (diastolisk/systolisk) foreligger det forholdsvis få studier, noen studier finner en sammenheng med luftforurensninger og PM ,5, andre finner ingen sammenheng [8, 167].
Det er også blitt undersøkt hvordan PM2,5 er forbundet med endringer i koagulasjonsfaktorer i blodet som von Willebrandts faktor og fibrinogen. For von Willebrandts faktor er det visse holdepunkter for en sammenheng, mens dette er mindre konsistent for fibrinogen [8, 167]. I en finsk studie med meget lave nivåer av forurensning (50 % av PM2,5-nivåene lik eller lavere enn 7,5 µg/m3) var blodnivåene av viktige betennelsesmarkører, som cytokinet IL12 og Creaktivt protein, assosiert med massen av PM2,5, men ikke partikkeltallet [171]. IL12-nivåene i blodet økte vesentlig under en episode med skogbrann.
PM2,5 og langtidsekponering
Sammendrag - PM2,5 og langtidsekponering
Langvarig eksponering for PM2,5 er i befolkningsstudier vist å være forbundet med økt dødelighet, og forekomst av lunge- og hjerte- og karsykdommer. Både eldre og nyere store kohortstudier har vist en økt risiko på mellom 4 og 20 % for total dødelighet ved 10 µg/m3 økning i PM2,5. Økt dødelighet av lungekreft er også forbundet med PM2,5-eksponering. Den økte dødeligheten forekommer i områder med gjennomsnittskonsentrasjoner fra 13 til 29 µg/m3 PM2,5. En reduksjon på 10 µg/m3 PM2,5 er beregnet å gi en økt levealder på 0,61 ± 0,20 år.
Befolkningsstudier viser at langvarig eksponering for PM2,5 er assosiert med økt forekomst av respiratoriske symptomer (kronisk hoste, bronkitt, astma), og redusert lungefunksjonsutvikling hos barn. Slike sammenhenger er vist ved årsgjennomsnitt ned mot 5-10 µg/m3 PM2,5. Reduksjon av PM2,5-nivåer synes å føre til reduksjon i både respiratoriske symptomer og sykdommer hos barn, og kan forbedre lungefunksjonsutviklingen.
Befolkningsstudier har også vist sammenheng mellom langvarig PM2,5-eksponering og forekomst av hjerte- og karsykdom, samt fortykkelser av blodåreveggene (arteriosklerotiske endringer). Flere studier kan tyde på at PM2,5 kan påvirke svangerskapsutfall, som for tidlige fødsler og lav fødselsvekt. Dette er fremdeles ikke tilstrekkelig dokumentert.
Dødelighet
Samlet sett har tidligere amerikanske kohortestudier (”ACS”, ”Harvard Six citystudy”, ”AHSMOG”, ”Veterans kohort”) rapportert at langvarig økning i PM2,5 var assosiert med økt forekomst av dødsfall [4, 8]. Risikoestimatene lå på mellom 4 og 13 % for total dødelighet, og 6 og 19 % for dødelighet av hjerte- og lungesykdom ved 10 µg/m3 økning i PM2,5. Senere studier har bekreftet denne assosiasjonen, både ved ulike re-analyser av de opprinnelige kohortstudiene og ved helt nye studier, i områder med middelkonsentrasjoner fra 13 til 29 µg/m3 PM2,5. Dette understøttes ytterligere ved at dødeligheten synes å gå ned når PM2,5-nivåene reduseres. Re-analysene tyder også på at de eldre studiene har underestimert størrelsen på risikoestimatene, og på at økningen i total dødelighet først og fremst kan tilskrives hjerte- og kar- og ikke respiratorisk dødelighet [140].
En oppfølgingsstudie til «Six city studien» fra 1993 observerte høyere risikoestimater for dødelighet enn tidligere, og sammenhengen var lineær for nivåer ned til 8 µg/m3 [172]. Dødelighetsratene varierte noe over tid, men faller ikke nevneverdig på tross av en samtidig betydelig reduksjon i sulfatnivåer. Nyere studier (”Women Healths Initiative, WHIkohorten”) tyder videre på en sammenheng mellom eksponering for PM2,5 og dødelighet av lungekreft [8]. Også sykelighet (hjerte-kar) og dødelighet ved PM2,5-eksponering er økt, noe som understøtter troverdigheten av disse observasjonene. Nyere studier har også ytterligere fokusert på betydningen av sammenhengen mellom reduksjon i luftforurensning og forventet levealder.
Det rapporteres at en reduksjon på 10 µg/m3 PM2,5 er assosiert med en økt levealder på 0,61 ± 0,20 år. Det understrekes imidlertid at denne tilsynelatende økningen i levealder for PM2,5 også kan overlappe med andre luftforurensningskomponenter. Assosiasjonen mellom langvarig eksponering for PM2,5 og dødelighet synes spesiell sterk for kvinner. Andre nyere kohorter viser også positive sammenhenger.
En stor kohortstudie fra USA (”Medicare Cohort Air Pollution Study”) viste økninger på 11,4 og 20,4 % i relativ risiko ved en PM2,5-økning på 10 µg/m3, avhengig av geografisk område. En kohortstudie fra Nederland (”NLCS”) viste en økning i relativ risiko på 6 % ved en økning på 10 µg/m PM2,5. I en annen amerikansk kohort hvor cystisk fibrosepasienter ble studert, ble det funnet en økning i relativ risiko på 32 % ved en økning på10 µg/m3 PM2,5, men effekten var ikke signifikant [8]. Ostro og medarbeidere [173] fant at forskjellige partikkelparametere inkludert PM2,5 var assosiert med økt total dødelighet og dødsfall på grunn av hjerte-/lungesykdommer. Økningen i dødelighet var opp mot 10 % per 10 µg/m3. USEPA2009 [8] konkluderer at det er tilstrekkelig bevis til å kunne fastslå en årsakssammenheng mellom langvarig PM2,5-eksponering og økt dødelighet.
Økt dødelighet hos spedbarn. Det er rapportert lite om langvarig eksponering for PM2,5 og økt dødelighet hos spedbarn. En større studie viser imidlertid en økning i risiko på 4 % ved en økning på 10 µg/m3 PM2,5, tilsvarende som for PM10 [174].
Luftveissykdommer
I mange tidligere studier er det vist en sammenheng mellom langvarig eksponering for PM10 og ulike luftveissymptomer og lungefunksjonsutvikling [8]. I de fleste av disse studiene ble de fine partiklene/PM2,5 regnet for å utgjøre mesteparten av PM10, og være hovedansvarlig for effekten av PM10. I flere separate studier er dette bekreftet ved at langvarig eksponering for PM2,5 er forbundet både med luftveissymptomer og lungefunksjonsutvikling [8]. PM2,5 synes å være sterkest assosiert med lungefunksjonseffekter ved astma, og viser høyere risikoestimater enn PM10. Effektene synes å forekomme ved gjennomsnittsnivåer (over år) av PM2,5 på mellom 11 og 20 µg/m (USEPA2009). For barn mellom 10 og 18 år synes effekter av PM2,5 på lungefunksjonsutviklingen å være lineær helt ned mot 510 µg/m3 PM2,5 [149]. Som for PM10 er PM2,5 blitt assosiert med ulke allergiske reaksjoner i øvre luftveier som høysnue), men i andre studier er det ikke funnet effekt [8]. For luftveisinfeksjoner synes assosiasjonen med langvarig eksponering for PM2,5 noe bedre dokumentert enn for PM10 [8].
Hjerte- og karsykdommer
Som beskrevet for PM10 har mulige sammenhenger mellom PM2,5 og ulike hjerte- og karsykdommer blitt undersøkt. Nyere studier styrker holdepunkter for at langvarig eksponering for PM2,5 er forbundet med ulike typer hjerte- og karsykdom og symptomer [8]. I en stor kohortstudie fant Miller og medarbeidere [175] at PM2,5 var forbundet med økt forekomst av total hjerte- og karsykdom (inkludert hjerteinfarkt og hjerneslag) på 24 % ved en økning på 10 µg/m3 PM2,5. Det er imidlertid til nå færre studier av PM2,5 enn av PM10. Det finnes også flere studier som viser at PM2,5 er forbundet med arteriosklerotiske endringer, som kan lede til bl.a. hjerteinfarkt, plutselig død og hjerneslag [8].
Effekter på fosterutvikling
Det er mye interesse for om PM og annen luftforurensning kan forstyrre fosterutviklingen ved eksponering av mødre under svangerskapet. Som for PM10 er det fremdeles uavklart i hvilken grad PM2,5 under svangerskapet bidrar til for tidlig fødsel, redusert fødselsvekt og utvikling av misdannelser (se avsnitt under PM10). Ytterligere studier er påkrevet for å avklare dette.
PM10-2,5 (grove partikler) - befolkningsstudier
Sammendrag - PM10-2,5 (grove partikler)
Det er langt færre befolkningsstudier som inkluderer PM10-2,5 (grovfraksjonen) enn PM10 og PM2,5, men det finnes studier som viser sammenheng både med dødelighet og sykelighet etter kortidseksponering. Totalt sett synes det å være grunnlag til å kunne foreslå en årsakssammenheng mellom kortvarig eksponering for grovfraksjonen og effekter på luftveier og hjerte- og karsystemet. Når det gjelder langtidseksponering av PM10-2,5 er det for få gode studier til å kunne trekke noen konklusjon.
PM10-2,5 og korttidseksponering
Dødelighet
Sammenhengen mellom kortidseksponering for grove partikler (PM10-2,5) og dødelighet er mye mindre studert enn for PM2,5. I WHO-rapporten fra 2005 [4] foreligger det ikke tilstrekkelige data fra Europa til å foreta en samlet analyse, mens det i USA og Canada var noe mer holdepunkter for en sammenheng mellom eksponering for PM10-2,5 og total, hjerte- og kar- og respiratorisk dødelighet. Spredningen i tallmaterialet var imidlertid stort, og effektene var for det meste ikkesignifikante.
Brunekreft og Forsberg [176] gjennomgikk i 2005 alle befolkningsstudier som inkluderte målinger av grovfraksjonen. Dette arbeidet indikerte at grovfraksjonen kunne ha effekt på dødelighet, men de fleste studiene viste imidlertid ingen effekt. Sammenhengen var derimot mye sterkere for PM2,5. I USEPA-rapporten fra 2009 [8] er datagrunnlaget utvidet, og det sies at disse studiene samlet sett viser konsistente positive sammenhenger. Den samlete analysen er imidlertid hovedsakelig foretatt i enkeltbyer, med varierende resultater, og spredningen i risikoestimater er ikke tallfestet. Nyere multisenterstudier viser også en sammenheng mellom kortvarig eksponering for grovfraksjonen og dødelighet [159, 177]. En mulig feilkilde ved denne studien, og også en del andre, er at grovfraksjonen ikke er direkte målt, men er beregnet som differensen mellom PM10 og PM2,5-verdier.
En ny studie fra Stockholm viser en 1,68 % økning i daglig dødelighet ved en 10 µg/m3 økning av PM10-2,5, og at sammenhengen var sterkest for perioden november-mai [178]. Studier av grove mineralpartikler fra sandstormer (Sahara eller andre ørkenområder) tyder på at disse kan gi økt dødelighet, selv om de ikke består av nybrutt kvarts. Risikoestimatene lå på omtrent samme nivå som for andre størrelsesfraksjoner [179].
Et kompliserende moment er at grovfraksjonen i nesten alle disse studiene ikke er karakterisert. Spørsmålet er om grovfraksjonen består av aggregerte forbrenningspartikler eller av større enkeltpartikler med mineralsammensetning. Dette kan være av betydning for tolkning av resultatene, og også forklare variasjon og spredning av resultatene.
Sykelighet
I vurderingen foretatt av Brunekreef og Forsberg [176] ble også en rekke befolkningsstudier analysert med hensyn til sykelighet forårsaket av grovfraksjonen. I denne gjennomgangen kom det frem at grovfraksjonen var minst like potent som finfraksjonen til å utløse helseeffekter i luftveiene som førte til besøk på sykehus. Også senere studier har vist sammenhenger mellom nivåer av grovfraksjonen og sykehusinnleggelser og legevaktbesøk på grunn av luftveissykdommer og hjerte- og karlidelser [8]. Når det gjelder luftveissykdommer er denne sammenhengen mest konsistent for barn. I en «casecrossover» studie av barn økte innleggelsen for infeksjoner i luftveiene med økende eksponering for grovfraksjonen av svevestøvet, og denne sammenhengen ble ikke påvirket av andre luftforurensningskomponenter [180]. Selv om det er observert sammenhenger også hos eldre, er det mer usikkert om PM-2,5-nivåene kan ha vært en forstyrrende faktor her.
En studie med eksponering for grove mineralpartikler fra sandstorm viser sammenheng med økt innleggelser for hjerte- og karsykdommer [179]. En nyere tidsseriestudie fra Hong Kong fant en sammenheng mellom grov fraksjonen og besøk hos akuttmottak på grunn av luftveissykdommer (KOLS, astma), og dette var lite påvirket av andre luftforurensningskomponenter [181]. Totalt sett mener USEPA [8] at det er tilstrekkelig bevis til å foreslå en årsakssammenheng mellom kortvarig eksponering for grovfraksjonen og effekter på luftveier og hjerte-karsystemet.
PM10-2,5 og langtidseksponering
Dødelighet
I tidligere store kohortstudier (”ACS”, ”Six Cities Study”) vises ikke noen sammenheng mellom langvarig eksponering for PM10-2,5 og dødelighet. Nyere funn gir begrenset bevis for en assosiasjon mellom langvarig eksponering for PM10-2,5 og dødelighet i områder med gjennomsnittskonsentrasjoner mellom 16 og 25 µg/m3. I en av studiene ble det funnet en sammenheng mellom konsentrasjoner av PM10-2,5 og hjerte- og kardødelighet spesielt hos eldre kvinner, med en økning i relativ risiko på 38 % ved 10 µg/m3 økning i PM10-2,5 [8]. Hos menn ble det ikke observert tilsvarende sammenheng. I en annen studie ble det funnet en tilsynelatende sammenheng mellom PM10-2,5 og total dødelighet, med en økning av relativ risiko på 7 % ved 10 µg/m3 økning i PM10-2,5. Samlet sett konkluderes det med at det er utilstrekkelig bevis for å avgjøre om det finnes noe årsakssammenheng mellom langvarig eksponering for PM10-2,5 og dødelighet [8]. I en nyere amerikansk studie [173] var flere partikkelparametere inkludert, også silisium som markør for mineralpartikler. Sammenhengen med dødelighet var like sterk for denne parameteren som for de andre.
Sykelighet
Det finnes svært få studier hvor det har vært mulig å beregne effekter av langtidseksponering for grovfraksjonen på sykelighet [176]. En studie fra Kina viste sammenheng mellom forekomst av respiratorisk sykdom hos barn og grovfraksjonen, mens en studie fra California derimot ga lite bevis for en slik sammenheng. I en senere studie ble det funnet en positiv, men ikke signifikant sammenheng, mellom eksponering for PM10-2,5 og betennelsesreaksjoner i luftveiene [8]. Det finnes også en enkelstudie hvor det ble påvist en sammenheng mellom grovfraksjonen og fødselsvekt, mens det var ingen sammenheng for finfraksjonen [182]. Samlet sett er det utilstrekkelige bevis for å avgjøre om det finnes noen årsakssammenhenger mellom langvarig eksponering for PM10-2,5 og effekter på hjerte-karsystemet, luftveiene eller på reproduksjonsparametere. Dette skyldes at det finnes for få gode studier til å kunne trekke noen konklusjon.
PM0,1 (ultrafine partikler) - befolkningsstudier
Sammendrag - PM0,1 (ultrafine partikler)
Befolkningsstudier kan tyde på en sammenheng mellom eksponering for PM0,1 og dødelighet, men datagrunnlaget er svært tynt. Derfor er det ikke mulig å si noe om en årsakssammenheng. Enkelte studier viser en sammenheng mellom PM0,1-nivåer og innleggelser på sykehus for respiratoriske sykdommer. De få befolkningsstudiene hvor effekter av PM0,1 på hjerte-karsystemet er studert, viser varierende resultater på hjerterytmevariabilitet, blodtrykk og markører for koagulering av blodet, samt sykehusinnleggelse for hjerte- og karlidelser, inkludert slag. Det finnes ingen studier av langtidseksponering for PM0,1 og effekter på dødelighet og sykelighet.
En størrelsesfraksjon av svevestøv som har fått betydelig oppmerksomhet de siste årene er de ultrafine partiklene (PM0,1). Ettersom en gitt vektmengde små partikler har et langt større totalt overflateareal og langt høyere partikkelantall enn en tilsvarende vektmengde store partikler, kan man forvente at små partikler er mer skadelige enn store partikler. I tillegg kan små partikler lettere krysse cellemembraner og slimhinnelag enn større partikler. Det foreligger imidlertid relativt få befolkningsstudier som har sett på betydningen av ultrafine partikler, sammenlignet med antall stider på PM10 og PM2,5.
PM0,1 og korttidseksponering
Dødelighet
Det er bare noen få studier som har rapportert sammenheng mellom ultrafine partikler (PM0,1) og dødelighet. Disse studiene tyder på en viss økning i relativ risiko for total dødelighet og dødelighet av lunge- og hjerte- og karsykdommer [8]. Sammenhengen var best med konsentrasjonen målt som partikkelantall. Datagrunnlaget var svært begrenset, og tiden mellom eksponering og helseutfall varierte mye i de foreliggende studiene. Nivåene av PM0,1 korrelerte også med ulike gasser fra lokale forbrenningskilder. USEPA konkluderte derfor med at videre forskning er nødvendig for å avklare betydningen av PM0,1 for økt dødelighet av svevestøv. Europeiske eksperter har gått gjennom litteraturen på ultrafine partikler, og har gjort de første kvantitative estimater av doseresponsfunksjoner mellom ultrafine partikler og total dødelighet [183].
Sykelighet
Et begrenset antall befolkningsstudier viser sammenheng mellom eksponering for ultrafine partikler i kort tid og respiratoriske symptomer, samt innleggelse på sykehus for astma. Studier foretatt i København og Helsinki rapporterer sammenheng mellom ultrafine partikler og sykehus-/legevaktbesøk for respiratoriske sykdommer, inkludert barneastma og lungebetennelse hos voksne. De gjennomsnittlige konsentrasjonene av antall partikler var drøyt 6000 partikler/cm3 i København og drøyt 8000 partikler/cm3 i Helsinki [184, 185]. Det ble derimot ikke funnet noen sammenheng i Atlanta, hvor gjennomsnittlig partikkelkonsentrasjon lå på 38 000 partikler/cm3 [8].
De få befolkningsstudiene hvor effekter av ultrafine partikler på hjerte-karsystemet er studert, viser varierende resultater på hjerterytmevariabilitet, blodtrykk og markører for koagulering av blodet, samt sykehusinnleggelse for hjerte- og karlidelser. Disse studiene gir derfor ingen sterk støtte for en sammenheng mellom PM0,1 og effekter på hjerte-karsystemet [8]. En dansk studie viste sammenheng mellom de ultrafine partiklene og innleggelse på sykehus for slag [186]. Denne sammenhengen var sterkere enn for andre komponenter, som PM10 og NOx. En annen studie viste sammenheng mellom ultrafine partikler og effekter på hjerte- og karsykdommer, spesielt alvorlige episoder med blodtrykkforstyrrelser [187]. I denne studien var effekten av de ultrafine partiklene mer alvorlig sammenlignet med PM2,5 og PM10. Funnene med ultrafine partikler kan imidlertid være vanskelig å tolke, fordi nivåene av de ultrafine partiklene har større geografisk variasjon enn PM2,5.
Totalt sett konkluderer USEPA2009 at studiene bare tyder på en årsakssammenheng mellom kortidseksponering for ultrafine partikler og effekter i luftveis og hjerte-karsystemene. En europeisk ekspertgruppe har også gjort doseresponsberegninger for sammenhengen mellom ultrafine partikler og sykehusinnleggelser [183].
PM0,1 og langtidseksponering
Ingen befolkningsstudier er utført for å belyse effekter av langtidseksponering for ultrafine partikler på sykelighet eller dødelighet [8]. USEPA vurderte derfor i 2009 at bevisene var utilstrekkelige for å kunne si noe om mulige årsakssammenheng mellom langtidseksponering for ultrafine partikler og dødelighet og sykelighet, som respiratoriske effekter, hjerte-kareffekter og effekter på reproduksjon og utvikling.
Svarte karbonpartikler - befolkningsstudier
Sammendrag - svarte karbonpartikler
Svarte karbonpartikler (”black smoke”, ”black carbon” eller ”elemental carbon”) er ofte blitt brukt som indikator i befolkningsstudier. Ved korttidseksponering er det funnet en assosiasjon med dødelighet, og sykehusinnleggelser både for astma og hjerte- og karsykdommer. For langtidseksponering er det observert en assosiasjon mellom svarte karbonpartikler og dødelighet og respiratoriske helseutfall, samt redusert lungefunksjonsutvikling. Risikoestimatene for svarte karbonpartikler på dødelighet og sykelighet er høyere enn for PM2,5 og PM10 både ved kortvarig og langvarig eksponering.
Forbrenningspartikler måles ved forskjellige metoder, og beskrives enten som ”black smoke” (BS), ”black carbon (BC) eller elemental carbon (EC) i befolknings studier. Som en standard omregning fra BS til EC er det vanlig å bruke at 10 µg/m3 BS tilsvarer 1,1µg/m3 EC. Det er foreslått at BC er en bedre indikator for helseskadelige komponenter, særlig fra trafikk, enn massen av PM2,5 eller PM10 [10].
Svart karbon og korttidseksponering
De fleste korttidsstudiene, hvor helseeffekter av svarte karbonpartikler er inkludert, er tidsseriestudier fra Europa, og data fra APHEA-studien dominerer. I en metaanalyse er det beregnet at 10 µg/m3 økning av henholdsvis PM10 og BS øker både dødelighet og antall sykehusinnleggelser. Eksempelvis ble den relative risikoen for dødelighet av hjerte- og karsykdom økt med 0,9 % (BS) og 0,6 % (PM10).
At BS synes å gi høyere risikoestimater enn PM10 støttes også av studier over sykehusinnleggelser for astma hos barn og for hjertesykdommer i alle aldersgrupper. En økning av partikler med 10 µg/m3 forårsaker økning i den relative risikoen for innleggelse for astma med 1,64 % (BS) og 0,69 % (PM10) og innleggelse for hjertesykdommer på henholdsvis 1,07 % og 0,51 % [10]. I en samlet analyse var økning av EC på 1 µg/m3 assosiert med en 1,77 % økning i den relative risikoen for dødsfall som skyldes hjerte- og karsykdom, mens for PM2,5 førte en tilsvarende økning av konsentrasjonen til 0,29 % økning av hjerte- og kardødsfall. Totalt sett synes risikoestimatene av helseeffekter å være mye større (68 ganger) for EC enn for PM2,5. I studier hvor effekter av svarte karbonpartikler (BC) er sammenlignet med massen av PM, tyder dataene på at effekten av BC også er sterkere enn for massen av PM2,5 [188]. I studien er det beregnet at en reduksjon i BC-nivå ville gitt 49 ganger større økning i forventet levetid enn en tilsvarende reduksjon i PM2,5.
Det er også utført flere panelstudier av barn med astma, hvor effekter av BS er sammenlignet med PM10, men disse studiene viste imidlertid små effekter, som ikke var signifikante.
Svart karbon og langtidseksponering
Det er utført noen kohortstudier hvor langtidseksponering for forskjellige partikkelparametere er inkludert. Ved omregning fra BS (10 µg/m3 BS = 1,1 µg/m3 EC) ligger relativ risiko for total dødelighet på 1,05-1,06 per 1 µg/m3 økning av EC. Denne risikoen er 7-16 ganger høyere enn for massen av PM2,5 [10]. Respiratoriske helseutfall, samt lungefunksjonsutvikling hos barn er beskrevet i flere artikler hvor effektene av svarte karbonpartikler og PM2,5 var godt korrelert. Totalt sett var risikoestimatene for effekter ved 1 µg/m3 økning av svarte karbonpartikler høyere enn for tilsvarende økning i PM2,5 [10].
Svevestøv fra ulike kilder - befolkningsundersøkelser
Sammendrag - svevestøv fra ulike kilder
Svevestøv kan ha forskjellige kilder som transport, oppvarming, industriutslipp og jorderosjon. Ulike kilder kan bidra til svevestøvet i et område. Det er derfor vanskelig å studere betydningen av enkeltkilder for helseeffekter i befolkningen. Trafikk synes å ha stor betydning og er den kilden som har vært studert mest. Det å bo nær svært trafikkerte veier har vist å være forbundet med helseeffekter.
Å skille svevestøv som kommer fra eksos og slitasjepartikler (veidekke, bremser) kan være vanskelig. Fra arbeidsmiljø finnes studier som viser at eksponering for dieseleksos øker forekomst av lungekreft og sannsynlighet for å dø av KOLS. Enkelte studier av veitrafikk kan tyde på at utslipp fra dieselkjøretøy er assosiert med større helseeffekter, som redusert lungefunksjon hos barn og astmatikere, enn utslipp fra bensindrevne biler. For vedfyringspartikler finnes det langt færre befolkningsstudier, men de tyder på at helseeffekter av vedfyringspartikler skiller seg lite fra svevestøv fra andre kilder.
Befolkningsstudier fra Skandinavia indikerer at grovt veistøv, dominert av slitasjepartikler fra veidekke, fører til økt antall sykehusinnleggelser for luftveissykdommer. Svevestøv fra industriområder med høyt metallinnhold synes å gi høyere forekomst av luftveissykdommer og allergier enn svevestøv fra områder med lavere metallinnhold.
Det er svært viktig å kartlegge den helsemessige betydningen av svevestøv fra ulike kilder, spesielt for å identifisere hvilke tiltak som er mest nyttig for å redusere luftforurensningen. I befolkningsstudier er det imidlertid vanskelig å skille mellom svevestøv fra forskjellige kilder. Det epidemiologiske datamaterialet er derfor begrenset, og det er vanskelig å beregne noen relativ risiko for helseutfall knyttet til nivå endringer i kildespesifikt svevestøv som for eksempel vedfyringspartikler. Bare fra trafikk er det flere ulike kilder, som dieseleksospartikler, bensineksospartikler, slitasjepartikler fra bildekk og bremseskiver og slitasje partikler fra veidekket. Enkelte studier har imidlertid inkludert markører for luftforurensningskomponenter som i noe større grad kan representere spesifikke partikkelkilder.
Trafikkrelatert svevestøv
Veitrafikk er av de viktigste kildene til svevestøv i mange byer eller byområder. Konsentrasjonen av svevestøv fra lokal trafikk er høyest i umiddelbar nærhet til trafikkerte veier og synker med økende avstand fra vei. I en avstand på 100-150 meter fra vei, kan svevestøvkonsentrasjonen være redusert til bakgrunnsnivået for det aktuelle området, men dette er meget avhengig av meteorologiske forhold [189]. En rekke parametere brukes i dag for å måle trafikk forurensing, inkludert NOx (markør for forbrennings motorer og høyt korrelert med konsentrasjonen av ultrafine eksospartikler), svarte karbonpartikler (mest elementært karbon hovedsakelig fra dieseleksos og ved/oljefyring), bostedsadresse (avstand til trafikkert vei), og måling av eller selvrapportert trafikkintensitet i bostedsområdet. Det er derfor mulig å relatere nærhet til trafikk til helseutfall. Slike sammenhenger synes å foreligge også ved trafikknivåer som forekommer i Norge. Imidlertid kan sosioøkonomiske forhold ha større betydning enn luftforurensning i noen studier. Andre studier tyder ikke på det, siden folk med høy sosioøkonomisk status også bor i de mest forurensede sentrumsområdene.
I en studie fra Nederland ble det funnet en sammenheng mellom økt forekomst av for tidlige dødsfall assosiert med å bo nær trafikkerte veier (50-100 m), med en økning i relativ risiko for å dø av hjerte- og karsykdom på 1,95. Tilsvarende var en 10 µg/m3 økning i svarte karbonpartikler forbundet med en økning i relativ risiko på 1,34 [189, 190]. I en studie fra USA var risikoen for akutt hjerteinfarkt økt med 5 % ved å bo nær trafikkert vei [191]. Det er også funnet økt forekomst av dødsfall ved hjertesvikt assosiert med bostedsadresser i nærheten av hovedveier eller nær bussrute [192]. I begge disse studiene fant man også at en økning av trafikktettheten nær bostedsadresse var forbundet med økt risiko for henholdsvis akutt hjerteinfarkt og død etter sykehusinnleggelse ved hjertesvikt [191, 192].
Sammenlignet med svevestøv fra enkelte andre kilder som partikler fra jorderosjon eller sekundære aerosoler, er trafikkrelatert svevestøv sammen med forbrenningspartikler funnet å være sterkere assosiert med endringer i hjertets elektriske aktivitet (forlenget repolarisering) og økte nivåer av betennelsesmarkører i blodet hos menn med hjertesykdom [193]. Det er også vist at å bo nær trafikkerte veier påvirker lungeutviklingen hos barn i større grad enn generell luftforurensning i samme område [194].
Dieseleksospartikler
Det foreligger ingen befolkningsstudier for den generelle befolkning som viser sammenhenger mellom dieseleksos alene og helseutfall, som forekomst av dødsfall eller innleggelse på sykehus. Derimot er det gjort en rekke studier i arbeidsmiljø på sammenhengen mellom dieseleksos og helseutfall, særlig kreft. Noen studier kritiseres for at det er få personer inkludert, mens i andre studier er karakteriseringen av eksponeringen for unøyaktig. Nyere studier med gruvearbeidere styrker imidlertid sammenhengen mellom dieseleksoseksponering og lungekreft [195].
Samlet sett synes det å være en sammenheng mellom høy eksponering i arbeidsmiljø for dieseleksos fra motorer med gammel teknologi og forekomst av lungekreft. En ny gjennomgang av disse studier har resultert i at dieseleksos nå karakteriseres som kreftfremkallende for mennesker, mot tidligere sannsynlig kreftfremkallende [58]. I en undersøkelse av dieseleksoseksponerte jernbanearbeidere i USA ble det funnet en økt sannsynlighet for KOLS-dødelighet, som økte med antall år i jobben. Personer som hadde jobbet over 16 år som konduktør eller mekaniker på dieseldrevne tog hadde økt relativ risiko for å dø av KOLS på 1,61 [196].
Inhalering av dieseleksos er vist å fremkalle sammentrekninger i luftveiene hos både friske og astmatiske personer. I nederlandske studier er det funnet at lastebil/trailertrafikk (dieseldrevne) var langt sterkere assosiert med effekter på lungefunksjon og kroniske luftveissymptomer hos barn enn hva den generelle biltrafikken var [197, 198]. I en feltstudie i London synes eksponering for hovedsakelig dieseleksos i «Oxford street» å føre til redusert pusteevne hos astmatikere og økt forekomst av betennelsesmarkører ved kort opphold (2 timer) i den trafikkerte gata sammenlignet med opphold i en park med lavere nivåer av forurensning. Det var imidlertid uklart i hvilken grad det er partikler eller gasser i dieseleksosen som utløste effektene [199]. I en annen studie med ny motorteknologi og bruk av partikkelfilter, som reduserte partikkelmengden med 46 %, ble ikke symptomene redusert. Dette kunne tyde på at stoffer i gassfasen var vel så viktige som partiklene i eksosen [200].
Bensineksospartikler
Det foreligger få studier som tar for seg bensineksos. Som tidligere nevnt, finnes det imidlertid enkelte studier som har observert forskjeller i helseutfall mellom områder dominert av kjøretøyer med dieselmotorer (lastebiler og busser) og områder med personbiltrafikk, hovedsakelig bensin. Disse studiene antyder at utslipp fra dieselmotorer kan være mer helseskadelig enn utslipp fra bensinmotorer [197, 198, 201, 202].
Forbrenningspartikler fra biomasse
Det er stor variasjon i mengder og sammensetning av utslippet fra ulike typer forbrenning av biomasse. Slik forbrenning skjer først og fremst ved oppvarming, men også ved branner, som f. eks. skogbranner. Sammensetningen av dette svevestøvet kan variere betydelig med type og mengde brensel, forbrenningstemperatur og oksygentilførsel. Fordi bruken av biomasse til oppvarming varierer betydelig, er det vanskelig å beregne eksponering av befolkningen. Slike beregninger i Norge viser store variasjoner.
Det foreligger likevel mange befolkningsstudier som omfatter den helsemessige betydningen av forbrenning av biomasse i utviklingsland, der bruk av forskjellig organisk materiale til matlaging eller varme er utbredt. Slike svevestøveksponeringer er assosiert med utvikling av KOLS, astma, lungekreft, økninger i luftveisinfeksjoner og tuberkulose, og økt spedbarnsdødelighet, og anslås av WHO å forårsake 12 millioner for tidlige dødsfall hvert år [203]. Det er imidlertid usikkert om de langt lavere nivåer ved biomasse forbrenning i land som Norge har tilsvarende helsemessig betydning.
En oversiktsartikkel om vedfyringsrøyk har konkludert med at de få studiene som finnes indikerer assosiasjoner med en rekke ulike luftveiseffekter, og at dette skiller seg lite fra effekter assosiert med svevestøv fra andre kilder. Sammenhengen med hjerte- og karsykdom synes imidlertid mindre klar [203]. To nylige studier indikerer at eksponering for vedfyringspartikler kan forårsake redusert lungefunksjon hos barn med astma, mens lungefunksjonen til friske barn synes å bli påvirket i mindre grad [204, 205]. En intervensjonsstudie fra USA tydet på at reduserte utslipp fra vedfyring førte til lavere forekomst av luftveissykdommer, inkludert infeksjoner, luftveissymptomer og influensa [206]. En studie fra Australia viste ingen forskjell i helseeffekter mellom to byer med henholdsvis mye vedfyring og mye trafikk [207]. I en studie av skogbrann i Canada ble det funnet at økte nivåer av svevestøv (PM10) førte til ca 5 % økning i antall legebesøk [208].
Mineralpartikler/slitasjepartikler
Mange steder kan svevestøvet bestå av store mengder erosjonspartikler. Episoder med støvskyer av sand fra Sahara eller andre ørkener har vist sammenheng med økt forekomst av dødsfall totalt og av luftveis- og hjerte- og karsykdommer [209, 210]. I noen studier ble det ikke funnet sammenheng mellom eksponering for partikler fra jorderosjon og dødelighet [201]. I mange skandinaviske byer bidrar veislitasje periodevis svært mye til svevestøvnivåene. I en befolkningsstudie fra Sverige var økte nivåer av grovt veistøv, dominert av slitasjepartikler fra veidekke, assosiert med økning i antall sykehusinnleggelser for luftveissykdommer [14]. I en senere studie ble det observert assosiasjoner mellom økt forekomst av dødsfall og eksponering for partikler fra veislitasje [178]. I Finland var PM10-nivåene bedre korrelert med lungefunksjonen hos astmatiske barn enn henholdsvis partikkelantallet og nivået av svarte karbonpartikler, under perioder med høye nivåer av veislitasjepartikler [5]. Tolkninger av disse studiene er vanskelig, da eksponeringssituasjon er sammensatt med mange andre partikler i tillegg til slitasjepartikler. Det er videre lite kunnskap om hvilke mineraler i slitasjepartiklene som har størst betydning for helseeffekter. Fra arbeidsmiljøstudier er det kjent at ulike mineraler kan føre til helseeffekter, med kvarts og asbest som de mest skadelige.
Langtransportert svevestøv (sekundære partikler)
Langtransportert luftforurensning inneholder en rekke oksidasjonsprodukter av svovel og nitrogen, deriblant sulfat og nitrat. Opprinnelige studier av den helsemessige betydningen av disse komponenter av PM ga motstridende resultater. Studier av sulfater og nitrater i nordøst-USA viste en sammenheng med helseeffekter [140], mens en rekke europeiske studier med korttidsksponering ikke viste noen sammenheng. Nyere data fra begge kontinenter [166, 173, 211], med bruk av ulike metoder, tyder imidlertid på at både sulfater og nitrater har en sammenheng med dødelighet (kort og lang tid) og sykelighet (kort tid).
Metallrike partikler fra industriområder
Det er utført flere befolkningsstudier som viser sammenhenger mellom uønskede helseeffekter og metaller i svevestøvet. Dette er oppsummert i en artikkel av Chen og Lippmann [86]. Grunnet store forskjeller mellom disse studiene når det gjelder sammensetningen av svevestøvet, antall analyserte metaller, analyseteknikker og deteksjonsgrenser, er det usikkert i hvilken grad metallene er indikatorer for andre faktorer som forårsaker effekter. I en nyere studie av Bell [211] synes nikkel og vanadium å ha større betydning for helseeffekter enn andre metaller. I denne rapporten vises det imidlertid til at data er utilstrekkelige til å konkludere om årsaker.
Generelt gir befolkningsstudiene et bilde av at svevestøv med høyt metallinnhold ser ut til å være mer skadelig enn svevestøv med lavt metallinnhold. Eksempelvis er hyppigheten av lungesykdommer sammenlignet i områder med og uten metallindustri. Disse studiene tyder blant annet på en økt forekomst av luftveissykdommer og allergier i områder med stålindustri [212], også flere år etter betydelige reduksjoner i utslippene [213]. Det kan ikke utelukkes at sosioøkonomiske forskjeller spiller en viktig rolle for disse sammenhengene. I en dansk studie er det undersøkt sammenhenger mellom personlig eksponering for forskjellige metaller i PM2,5-fraksjonen av svevestøv og DNA-skade på enkelte typer immunceller (lymfocytter) [214]. Det ble funnet at metallene vanadium og krom, men ikke jern, nikkel, kobber og platina, var assosiert med DNA-skader i lymfocytter.
Vurderinger og luftkvalitetskriterier for svevestøv
Vurderinger foretatt av WHO
I WHO- rapporten ”Air quality guidelines for Europe” fra 2005 fastsatte WHO retningslinjen for 24-timersmiddel for PM10 til 50 μg/m3 og for PM2,5 til 25 μg/m3. For langtidseksponering har WHO fastsatt årsmidler for PM10 på 20 μg/m3 og PM2,5 på 10 μg/m3. For både PM10 og PM2,5 er retningslinjene basert på befolkningsstudier. Stort sett ligger de fastsatte retningslinjene for årsmidlene omtrent på samme nivå som de laveste konsentrasjonene som gir signifikante økninger i dødelighet. For korttidsnivåer rapporterer WHO bare assosiasjoner for høyere nivåer enn retningslinjene. Basert på multisenterstudier og metaanalyser beskrives assosiasjon med økt daglig dødelighet på ca 2,5 % ved nivåer rundt 100 μg/m3 PM10 og 50 μg/m3 PM2,5. I fastsettelsen av retningslinjen argumenterer WHO med statistiske sammenhenger mellom 24-timersmiddel og årsverdier, og kommenterer at de enkelte land må ta hensyn til lokale forhold i fastsettelsen av retningslinjene. For PM0,1 har ikke WHO fastsatt noen retningslinjer, da de mener det foreligger utilstrekkelige med data spesielt når det gjelder befolkningsstudier.
Luftkvalitetskriterier
Luftkvalitetskriterier for døgnmidler settes til 30 μg/m3 for PM10 og 15 μg/m3 for PM2,5. For årsmidler fastsettes luftkvalitetskriterier til 20 μg/m3 for PM10 og 8 μg/m3 for PM2,5. Dette er basert på befolkningsstudier. Ved disse kriteriene er også følsomme individer tatt hensyn til. For PM0,1 (ultrafine partikler), PM10-2,5 (grovfraksjonen) og svarte karbonpartikler eller andre partikkelparametere foreligger det ikke tilstrekkelige data til å fastsette egne luftkvalitetskriterier.
Sammenhengen mellom PM og helseeffekter ansees som godt etablert i befolkningsstudier, og disse viser lineær doserespons ned mot svært lave konsentrasjonsområder av PM. Helseeffektene som er studert er dødelighet, samt både hjerte- og kar- og respiratorisk sykelighet.
For døgnmiddel (24 timer) er det sett sammenhenger for PM10 i konsentrasjoner ned mot 20 μg/m3, men de fleste studiene lå fra 25 til 30 μg/m3. For PM 2,5 er det vist assosiasjoner i konsentrasjonsområdet 6-8 μg/m3, men de fleste studiene lå mellom 10 og 15 μg/m3. For årsmiddel av PM10 er det sett en slik sammenheng i konsentrasjonsområdet 20-30 μg/m3, og for PM2,5, ved konsentrasjoner fra 5 til 10 μg/m3.
Disse sammenhengene med langvarig eksponering for PM2,5 er bedre dokumentert enn for PM10, og legges mest vekt på i anbefalingene. I fastsettelsen av luftkvalitetskriterier legges det vekt på at følsomme grupper også skal beskyttes mot helseskader. Dette inkluderer personer med luftveis- og hjerte- og karsykdommer, spesielt barn og eldre.
For PM0,1 finnes ennå ikke tilstrekkelig med studier til å kunne anbefale noen luftkvalitetskriterier. For PM10-2,5 finnes noe mer data, men fremdeles ikke nok til å kunne anbefale noe eget luftkvalitetskriterium. PM10-verdien vil imidlertid inkludere partikler i denne fraksjonen. Derfor er det viktig å beholde en PM10-verdi i tillegg til luftkvalitetskriteriet for PM2,5. For ”svarte karbonpartikler” er det funnet sterke sammenhenger med ulike helseutfall, og med høyere risikoestimater enn for PM10 og PM2,5.
På nåværende tidspunkt anbefales imidlertid ikke å innføre eget luftkvalitetskriterium for svarte karbonpartikler. Dette skyldes manglende standardisering av målemetoder, samt at PM2,5 dekker mye av det samme, og er målt over lang tid og mange steder. Hvis en parameter for svarte karbonpartikler skal innføres må dette komme i tillegg til PM2,5.
På dette grunnlag er det fastsatt følgende luftkvalitetskriterier:
- Døgnmidler:
- PM2,5 15 µg/m
- PM10 30 µg/m
- Årsmidler:
- PM2,5 8 µg/m
- PM10 20 µg/m
Dette er basert på en rekke befolkningsstudier som viser sammenheng med sykdommer og dødsfall, og som mer eller mindre er justert for andre luftforurensningskomponenter og andre variabler. Siden befolkningsstudiene indikerer effekter ned mot luftkvalitetskriteriene, kan det ikke utelukkes at enkelte svært følsomme individer kan reagere ved konsentrasjoner tilsvarende luftkvalitetskriteriene. Befolkningsundersøkelser viser imidlertid ingen årsakssammenheng alene. Eksperimentelle studier i dyr og mennesker understøtter de observerte helseeffektene av svevestøv, men ved høyere konsentrasjoner av PM.