Antibiotikaresistens i Norge
Oppdatert
|Både antallet som er friske bærere av resistente bakterier, og antallet pasienter som har infeksjoner med slike bakterier, har økt. I Norge har vi så langt kunnet kontrollere forekomsten av antibiotikaresistens, men smittepresset kan etter hvert blir så stort at smitteverntiltakene i og utenfor helsetjenesten ikke lenger er tilstrekkeliges.

Hovedpunkter
- Det er et økende problem at bakterier utvikler resistens mot antibiotika, selv om forekomsten i Norge fortsatt er relativt lav.
- De viktigste tiltakene for å motvirke resistensutvikling er å forebygge infeksjoner og begrense antibiotikabruk.
- En vanlig type antibiotikaresistente bakterier er gule stafylokokker som har utviklet resistens mot antibiotikatypene betalaktamer og de fleste cefalosporiner (MRSA; meticillinresistente Staphylococcus aureus).
- Infeksjoner med MRSA er en særlig trussel for sykehuspasienter. Dersom forekomsten av MRSA på helseinstitusjoner øker, kan behandlingen av stafylokokkinfeksjoner bli mindre effektiv og betydelig dyrere.
- Forekomsten av blodforgiftninger og andre infeksjoner med ESBL-holdige bakterier har økt dramatisk internasjonalt og er også økende i Norge.
- For gonoré er nå bare noen få behandlingsalternativer tilgjengelig.
Om antibiotikaresistens
Resistens kan vi se hos alle typer mikrober, både bakterier, virus, sopp og parasitter. Vi omtaler her i hovedsak antibiotikaresistens, det vil si resistens hos bakterier.
Antibiotikaresistens innebærer at bakterier kan leve videre og formere seg selv om de utsettes for antibiotika. Noen bakterier er naturlig resistente overfor enkelte antibiotika. Både disse og andre bakterier kan utvikle resistens mot antibiotika som de utsettes for.
Bakterier som er resistente mot to eller flere antibiotika, kalles multiresistente.
Resistente bakterier er normalt ikke mer sykdomsfremkallende enn vanlige følsomme bakterier, men når de gir sykdom, er disse infeksjonene vanskeligere å behandle enn andre infeksjoner. Pasienten kan få et mer langvarig sykdomsforløp med større fare for komplikasjoner og høyere dødelighet. I tillegg vil de antibiotikatypene som man må bruke ved slike infeksjoner medføre økt risiko for at enda mer resistente bakterier dukker opp. I verste fall risikerer pasienten å få en infeksjon som skyldes en bakterie som er motstandsdyktig mot alle tilgjengelige antibiotika.
Bakterier kan bli resistente mot antibiotika på flere måter, først og fremst ved mutasjoner i sitt eget arvestoff eller ved å hente resistensgener fra andre bakterier.
Hvordan sprer antibiotikaresistens seg?
Antibiotikaresistens sprer seg ved at resistente bakterier smitter mellom mennesker, dyr og miljø, og ved at resistensgener sprer seg mellom bakterier, både hos enkeltpersoner og i miljøet. Antibiotikaresistente bakterier vil ofte etablere seg i den normale bakteriefloraen, for eksempel blant bakteriene i tarmen. Personene blir da bærere av antibiotikaresistente bakterier. Bærere blir ikke nødvendigvis syke, men kan bidra til spredning av antibiotikaresistens.
- Les mer om antibiotikaresistens på temasiden Antibiotikaresistens
Overvåking av antibiotikaresistens i Norge
Overvåking av utvikling av antibiotikaresistens hos mikrober er nødvendig dersom helsetjenesten også i fremtiden skal kunne levere medisinsk behandling på en trygg måte. I Norge overvåkes antibiotikaresistens gjennom følgende systemer:
- Meldingssystem for smittsomme sykdommer (MSIS).
- Norsk overvåkingssystem for antibiotikaresistens hos mikrober (NORM).
- Norsk overvåkingssystem for antibiotikaresistens hos mikrober – veterinærmedisin (NORM-VET).
Nedenfor følger tall og diagrammer med omtale av ulike antibiotikaresistente bakterier, med beskrivelse av dagens situasjon og utvikling over tid.
Meticillin-resistente gule stafylokokker (MRSA)
Gule stafylokokokker (Staphylococcus aureus) er bakterier som er vanlige på hud og slimhinner hos mennesker. Mellom 20 og 40 prosent av befolkningen er friske bærere som ikke har symptomer på sykdom. De fleste av oss kommer i kontakt med gule stafylokokker i løpet av livet. Hos friske personer gir bakteriene sjelden sykdom, men i helseinstitusjoner er S. aureus en av de bakterietypene som oftest påvises som årsak til infeksjon.
Meticillinresistente S. aureus (MRSA) skiller seg ikke fra «vanlige» antibiotikafølsomme gule stafylokokker når det gjelder smittefare eller evne til å gi sykdom. Men de er resistente mot alle antibiotika som man vanligvis kan bruke til å behandle stafylokokkinfeksjoner. Resistensen gjør det vanskeligere å behandle infeksjoner som skyldes MRSA.
Det er i tillegg funnet resistens mot et annet «siste utvei»-antibiotikum; linezolid, hos gule stafylokokker og enterokokker (Doern, 2016; Gu, 2013).
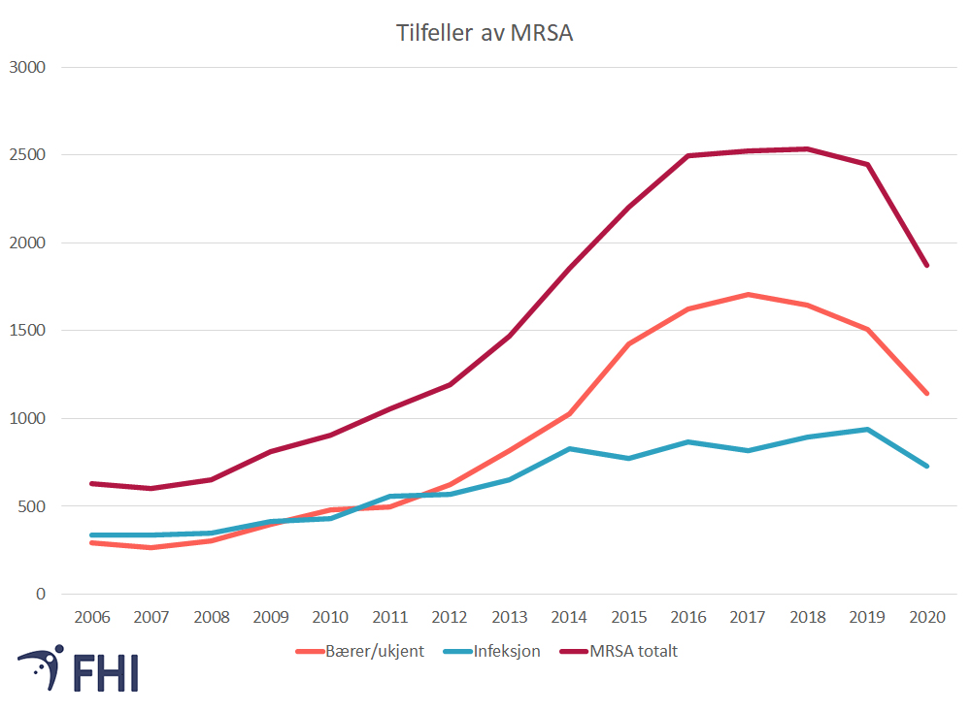
Meldte tilfeller av MRSA per år
Det har vært en utflating og svak nedgang i meldte tilfeller av bærerskap. I 2020 ble det totalt meldt 1874 tilfeller med MRSA, hvorav 730 tilfeller av MRSA-infeksjon og 1144 tilfeller av bærerskap (FHI, 2021).
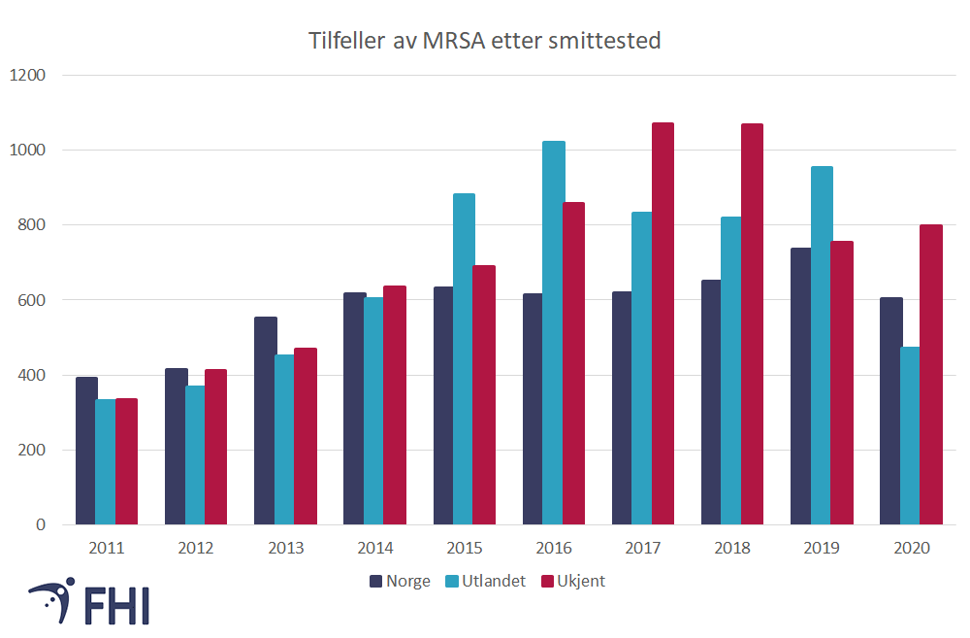
Hvor skjer MRSA-smitte?
I 2020 ble rapportert at 472 (ca 25%) av MRSA-tilfellene var assosiert med smitte i utlandet. Dette er den laveste andel importsmitte på ti år, med det forbehold at over 1/3 av tilfellene var meldt uten informasjon om smittested.
Norge har lavere forekomst av MRSA enn de fleste andre land
Norge har en av de lavest registrerte forekomstene av MRSA i verden. Ved blodforgiftninger som skyldes gule stafylokokker er andelen som skyldes MRSA over 20 prosent i de fleste land i Europa, og ofte over 50 prosent i andre deler av verden. I Norge er andelen rundt én prosent.
MRSA-kontroll – en særlig utfordring i sykehus og sykehjem
Infeksjoner med MRSA er en særlig trussel for sykehuspasienter, personer med svekket immunforsvar og eldre. Disse gruppene er mer utsatte for alvorlige infeksjoner og er avhengige av riktig antibiotikabehandling tidlig i infeksjonsforløpet. Dersom forekomsten av MRSA på helseinstitusjoner øker, kan behandlingen av stafylokokkinfeksjoner bli mindre effektiv og betydelig dyrere.
Om økningen i samfunnet fortsetter og på sikt medfører en høy forekomst av MRSA i befolkningen, er dagens smitteverntiltak ikke hensiktsmessige og nye strategier må utvikles for å hindre at MRSA etablerer seg i sykehus og sykehjem.
MRSA i norsk svineproduksjon
En annen trussel er forekomsten av dyre-assosiert MRSA (LA-MRSA=livestock associated MRSA). I Danmark og andre europeiske land er dette et stort problem i svineproduksjonen. Det har vært utbrudd av LA-MRSA også i norsk svineproduksjon. Store ressurser og nye overvåkingsprogrammer er satt inn for å hindre videre spredning og etablering av LA-MRSA i landet. Norge er eneste land vi vet som har en egen nasjonal strategi for å forebygge og bekjempe MRSA i husdyrbesetninger (Mattilsynet, 2016).
Vankomycinresistente enterokokker (VRE)
Enterokokker er bakterier som lever i tarmen. De er vanligvis ikke spesielt aggressive bakterier, men de kan gi alvorlige infeksjoner hos svekkede personer. Enterokokkene er allerede naturlig resistente mot en rekke antibiotika. Dersom de også utvikler resistens mot et av de få antibiotika som vanligvis er virksomme mot enterokokker; vankomycin eller linezolid, og det oppstår en infeksjon med vankomycin- og/ eller linezolidresistente enterokokker (VRE, LRE), blir behandlingen vanskelig fordi det er få alternative legemidler.
VRE i Norge
Før 2010 var det under 10 meldte tilfeller med vankomycinresistente enterokokker (VRE) per år til MSIS. Fra 2010 har Norge hatt flere større utbrudd med VRE i sykehus, med topper i 2011 og i 2017 (se figur 3). I 2020 er det en kraftig reduksjon av meldte tilfeller til MSIS, med kun 71 meldte tilfeller. Dette er en nedgang på 63 prosent fra 2019.
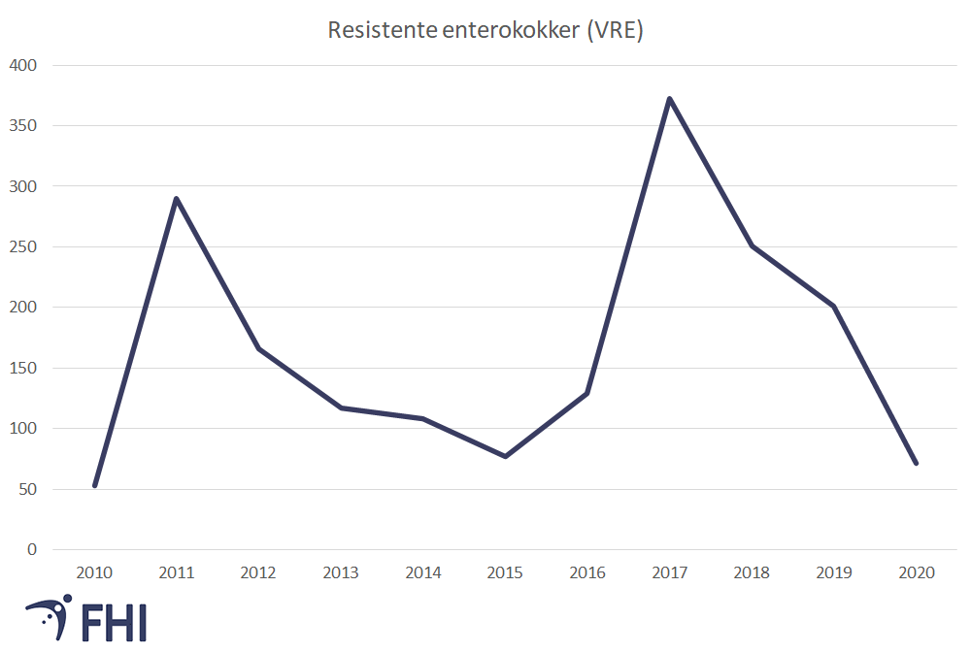
Omfattende tiltak med smitteoppsporing, screening og isolering har gjort at VRE-utbruddene i sykehus er under kontroll.
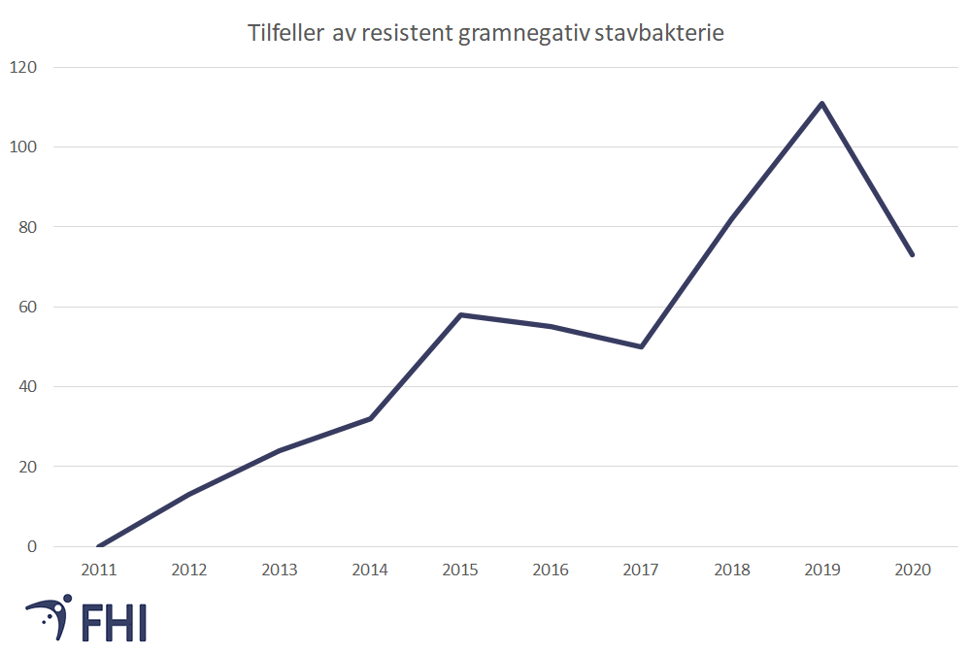
Resistens hos gramnegative stavbakterier
Det finnes mange ulike typer resistens hos gramnegative stavbakterier. En gruppe mekanismer som har stor praktisk betydning er ESBL. ESBL er forkortelse for extendert spektrum betalaktamaser, og er en resistensmekanisme som inaktiverer noen av de viktigste antibiotikatypene vi har for behandling av infeksjoner, særlig infeksjoner som skyldes tarmbakterier som E.coli. Det finnes mange varianter av ESBL-resistensmekanismen.
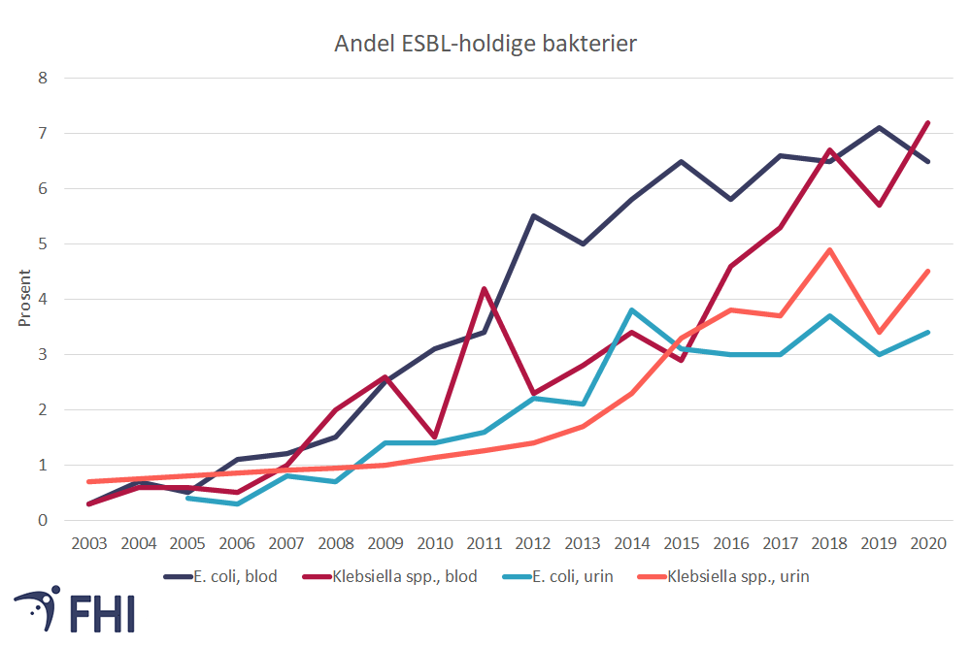
ESBL-holdige bakterier - økende forekomst
Forekomsten av infeksjoner som skyldes ESBL-holdige bakterier har økt dramatisk internasjonalt og er også økende i Norge. For eksempel har andelen av E. coli med ESBL i blodforgiftninger de siste 10 årene tidoblet seg og var i 2016 steget til 6,5 prosent av alle blodforgiftninger med E.coli i Norge. Tallet har holdt seg stabilt siden 2016, men forekomsten er like fullt bekymringsfull.Reisevirksomhet er antakelig en viktig årsak til spredningen av ESBL-holdige bakterier globalt. Det er stor risiko for å bli bærer av mikrober med ESBL eller andre resistensmekanismer ved reiser i sør- og Sørøst-Asia og Afrika, men også i Sør-Europa (Lubbert, 2015).
Det er særlig fryktet at bakterier som har resistensmekanismen ESBLKARBA spres til norsk helsevesen. Denne formen for ESBL-resistens er den mest omfattende og gir få behandlingsmuligheter for rammede pasienter.
Meldingsplikt for ESBLKARBA startet i 2012, og antall personer meldt med infeksjoner forårsaket av disse bakteriene har hittil vært svært lavt. Antall meldte tilfeller har gått ned under pandemien, antagelig på grunn av nedsatt reisevirksomhet, noe som understreker at mange av disse infeksjonene kan forklares ved importsmitte. Det er rapportert om stadig flere utbrudd med slike infeksjoner internasjonalt. Ved alvorlige infeksjoner gir resistens hos bakteriene en økt risiko for død (Souli, 2010). Det er derfor viktig å fortsatt ha fokus på forebygging av ESBL-infeksjoner.
Ovenfor har vi omtalt mikrober med resistensmekanismer med særlig betydning i helseinstitusjoner. I samfunnet for øvrig kan det være mikrober med andre resistensmekanismer som har stor betydning, og vi vil spesielt nevne resistens ved tuberkulose og gonoré.
Multiresistent tuberkulose (MDR-TB)
I Norge har vi de siste årene behandlet 1-12 tilfeller av multiresistent tuberkulose årlig. I 2020 var det et enkelt isolat som ble definert som MDR mot både rifampicin og isoniazid, mens et annet isolat kun var resistent mot rifampicin, hvilket var en nedgang i forhold til de siste årene (FHI, 2021). Internasjonalt er multiresistent tuberkulose et stort og økende problem. Spesielt er problemet stort i land som var en del av det tidligere Sovjetunionen.
For å hindre at tuberkulosebakterien utvikler resistens, er det viktig å behandle pasienten med minst tre medikamenter samtidig. I tillegg må medikamentene tas i en tilstrekkelig lang periode, det vil si 6-12 måneder.
WHO anbefaler at tuberkulosemedisiner tas som direkte observert behandling (DOT). Det innebærer at helsepersonell følger opp pasienten gjennom hele behandlingsforløpet, og ser på at pasienten tar medisinen sin hver dag. Norge slutter seg til denne anbefalingen, med noen tilpasninger til den enkelte pasient, se Tuberkuloseveilederen for helsepersonell.
Resistens ved gonoré
Forekomsten av gonoré er økende i Norge. I 2020 ble det diagnostisert 442 tilfeller (FHI, 2021)
Bakterien som forårsaker gonoré, Neisseria gonorrhoeae, har vist en forbløffende evne til å utvikle resistens. Det er nå bare noen få behandlingsalternativer tilgjengelige som bakterien ikke er resistent mot eller har nedsatt følsomhet for. I Norge må gonoré i dag behandles med intramuskulær injeksjon med antibiotika.
Resistens hos virus
Man ser også resistensproblemer i legemidler mot andre mikrober, slik som midler mot virus (antivirale midler). Det oppstår virusstammer som er motstandsdyktige eller resistente mot disse legemidlene.
Eksempler på resistens hos virus er resistens mot influensamiddelet oseltamivir, mot hiv-midler og mot midler som benyttes ved leverbetennelse (virushepatitt).
Utfordringer
Økt smittepress
Internasjonalt har det vært økende rapportering av tilfeller der pasienter har en infeksjon med bakterier som er motstandsdyktige mot alle tilgjengelige antibiotika. Dette gjelder også i Europa. Det fryktes at slike multiresistente bakterier skal få fotfeste, særlig i helsetjenesten. Problemet med resistens er foreløpig mindre i Norge enn i de fleste andre land, se tall ovenfor under avsnittene om MRSA, VRE og ESBL.
Økt antibiotikabruk, reisevirksomhet, import av mat og spredning av resistente bakterier i matproduksjonen kan imidlertid endre situasjonen. I Norge har vi så langt kunnet kontrollere forekomsten av antibiotikaresistens ved iherdige og omfattende smitteverntiltak både i og utenfor helsetjenesten, men smittepresset kan etter hvert bli så stort at tiltakene ikke lenger er tilstrekkelig.
Utvikling av nye antibiotika har stoppet opp
Kombinasjonen av økende forekomst av resistens og stopp i utvikling av nye antibiotika er årsaken til at WHO og andre internasjonale organer (ECDC) mener at antibiotikaresistens er en alvorlig trussel for framtidig medisinsk behandling (https://www.who.int/health-topics/antimicrobial-resistance )). Utviklingen av nye antibiotikaklasser har de siste 30 årene stoppet opp, og kun noen få nye antibiotika er kommet på markedet.
Det er imidlertid flere initiativ internasjonalt for å bedre denne situasjonen, som f. eks. testing av nye insentiver i Storbritannia og Sverige. Disse insentivene sikter på å belønne utvikling av nye viktige antibiotika og betaler for tilgjengelighet istedenfor bruk. Dagens modell der lønnsomhet baseres på enhetssalg er ikke forenlig med det internasjonale samfunnets arbeid for å redusere antibiotikabruken.
Tiltak for forebygging av antibiotikaresistens
Bevisstheten omkring det voksende problemet med antibiotikaresistens har vært stadig økende, og i 2015 publiserte Regjeringen Nasjonal strategi mot antibiotikaresistens 2015 – 2020 (HOD, 2015). Det er nå igangsatt en prosess for å utarbeide en ny strategi og i den forbindelse er det blant annet publisert en kunnskapshullrapport (Simonsen et al., 2020). Virkningstiden til strategien er forlenget i påvente av en ny. Det foreligger også sektorspesifikke mål for helsetjenesten, matproduserende landdyr og kjæledyr, fisk og klima og miljø.
Helse- og omsorgsdepartementet (HOD) publiserte i 2016 en handlingsplan mot antibiotikaresistens i helsetjenesten, som viser hvilke tiltak HOD vil sette i verk for å nå målene i strategien (HOD, 2016). Tiltakene er organisert under seks tiltaksområder; nasjonal organisering av arbeidet, tiltak rettet mot den generelle befolkningen, tiltak rettet mot fastleger og legevaktsleger, mot spesialisthelsetjenesten, kommunale helseinstitusjoner og tannhelsetjenesten.
Videre publiserte HOD i 2019 en handlingsplan for et bedre smittevern (Helse- og omsorgsdepartementet, 2019). Handlingsplanen har som hovedmål å redusere helsetjenesteassosierte infeksjoner og gi en bedre organisering og struktur av smittevernet i Norge.
Nedenfor utdypes noen av disse punktene.
Redusere antibiotikaforbruket
Det viktigste forebyggende tiltaket er å begrense antibiotikabruk og å bruke antibiotika riktig. Det innebærer blant annet å velge smalspektrede i stedet for bredspektrede antibiotika.
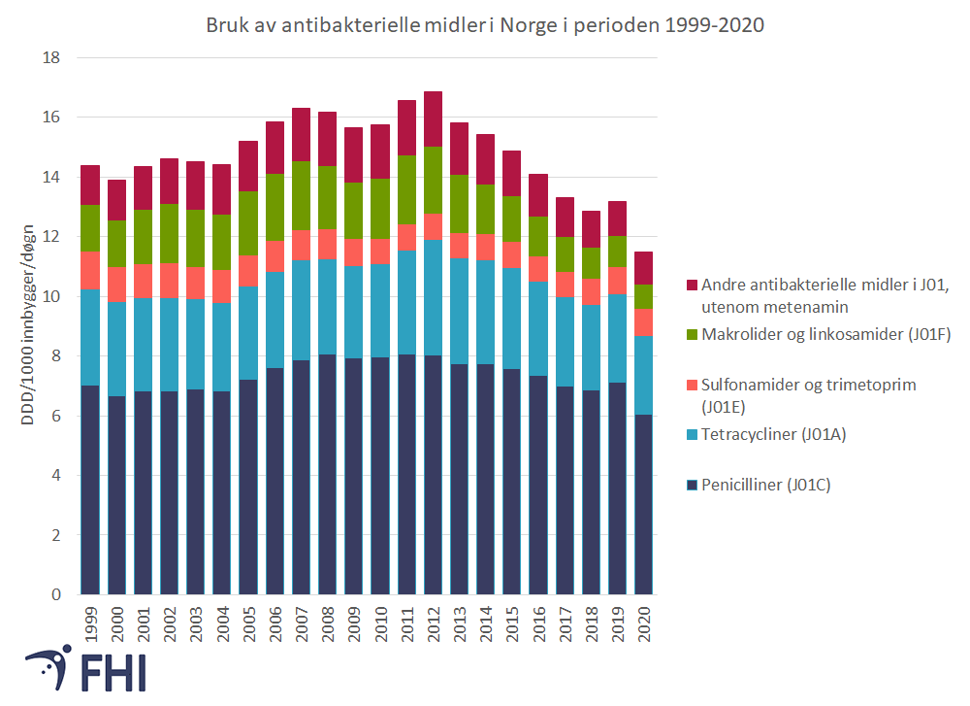
Antibiotikabruken i Norge har gått ned siden 2012, i alt en nedgang på 32 prosent. Om lag 84 prosent all antibiotikabruk hos mennesker skjer i dag utenfor sykehus og sykehjem (NORM/NORM-VET, 2021).
I Norge ble det i 2020 brukt 5 tonn antibiotika til husdyr og 0,2 tonn til fiskeoppdrett (NORM/NORM-VET, 2021). Antibiotikabruken i landbruket er et viktig bidrag til det samlede forbruket globalt. Norsk landbruk har et lavt forbruk sammenliknet med andre land. Særlig nedgangen i forbruk av antibiotika i fiskeoppdrett fra 48 tonn i 1987 til 223 kg i 2020, en nedgang på 99,9 prosent, er et eksempel på en positiv utvikling.
Bruke smalspektrede i stedet for bredsprektrede antibiotika
Smalspektrede antibiotika påvirker færre bakterietyper, og forårsaker dermed mer begrenset resistensutvikling.
Forbruket av antibiotika i Norge har en gunstig sammensetning, med størst forbruk av smalspektret penicillin , se figur 6.
Finn flere tall om antibiotikabruk:
- Norgeshelsa statistikkbank, tall for landet og fylkene: bruk av smalspektrede antibiotika mot luftveisinfeksjoner
- Kommunehelsa statistikkbank, tall for kommuner: bruk av smalspektrede antibiotika mot luftveisinfeksjoner
Begrense forurensning av miljø og spredning av resistente bakterier
Antibiotikaforbruket i matproduksjonen gir grunn til bekymring, fordi spredning av resistente mikrober til miljøet er svært uønsket, og spredning til mennesker kan forekomme. Vi har nevnt LA-MRSA i husdyr. Vi har allerede hatt utbrudd i dyrebesetninger i Norge, men dette er et mye større problem i andre europeiske land. Det er også påvist E. coli-bakterier med ESBL og resistens mot kinolon-antibiotika i norsk kylling (NORM/NORM-VET, 2012).
Reisevirksomhet: Spredning av antibiotikaresistens fra land og områder med høy forekomst av resistens til områder med lav forekomst, kan knyttes til reisevirksomhet (Lubbert, 2015; Tangden, 2010). I områdene med høy forekomst finnes mye resistente bakterier i miljøet. Det kan være svært vanskelig å unngå å få i seg disse gjennom for eksempel mat.
Det er også en risiko å bli smittet med antibiotikaresistente bakterier hvis man legges inn eller behandles i helseinstitusjoner i land med høy forekomst av resistens. Dette gjelder både ESBL-holdige tarmbakterier, MRSA, VRE og andre.
Smittevern i helsetjenesten er essensielt
Det legges til enhver tid en stor innsats ned i smittevernarbeid i den norske helsetjenesten. Dette er essensielt i arbeidet for å begrense antibiotikaresistens, fordi det hindrer infeksjoner i å oppstå, og dermed holde behovet for antibiotikabehandling på lavest mulig nivå. Det er helt vesentlig at dette arbeidet prioriteres, særlig sett i lys av et stadig økende smittepress (Tangden, 2015).
Om en kan opprettholde de strenge smitteverntiltakene i helsetjenesten og fortsatt ha en restriktiv bruk av antibiotika, er det håp om at forekomsten av antibiotikaresistens kan holdes på dagens lave nivå.